Ôn tập chương 5
1. Tính chất vật lý:
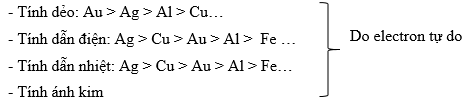
- Khối lượng riêng: Os lớn nhất, Li nhỏ nhất
- Nhiệt độ nóng chảy: W lớn nhất, Hg nhỏ nhất
- Tính cứng: Cr cứng nhất, Cs nhỏ nhất
Tính chất hóa học: Tính khử: $M\xrightarrow{{}}{{M}^{n+}}+ne$
- Tác dụng với phi kim:
|
3Fe + 2O2 $\xrightarrow{{{t}^{\circ }}}$ Fe3O4 (FeO.Fe2O3) |
|
|
2Fe + 3Cl2 $\xrightarrow{{{t}^{\circ }}}$ 2FeCl3 2Fe + 3Br2 $\xrightarrow{{{t}^{\circ }}}$ 2FeBr3 |
Fe + S $\xrightarrow{{{t}^{\circ }}}$FeS Fe + I2 $\xrightarrow{{{t}^{\circ }}}$FeI2 |
- Tác dụng với axit:
+) H2SO4 loãng, HCl (${{H}^{+}}$) + kim loại trước H $\xrightarrow{{}}$ H2↑ + muối (kim loại có hóa trị thấp)
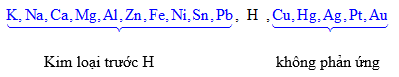
+) H2SO4 đặc nóng, HNO3 + hầu hết các kim loại ( trừ Au,Pt) tạo muối (kim loại có hóa trị cao) + sản phẩm khử + H2O
3Cu + 8HNO3 (l) $\xrightarrow{{}}$ 3Cu(NO3)2 + 2NO↑ + 4H2O
2$\overset{0}{\mathop{Fe}}\,$ + 6H2SO4 (đặc) $\xrightarrow{{{t}^{\circ }}}$ ${{\overset{+3}{\mathop{Fe}}\,}_{2}}{{(S{{O}_{4}})}_{3}}$ + 3SO2↑+6H2O
* Fe, Al, Cr thụ động (không phản ứng) với HNO3 đặc nguội, H2SO4 đặc nguội
2. Dãy điện hóa:
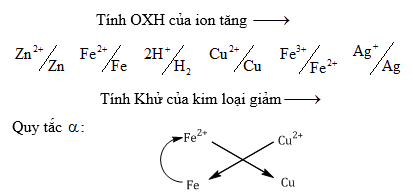
* Tác dụng với ${{\overset{+1}{\mathop{H}}\,}_{2}}O$ : Kim loại kiềm, Ca, Ba, Sr (t0 thường)
Na + H2O $\xrightarrow{{}}$ NaOH + $\frac{1}{2}$ H2↑
Ba + 2H2O $\xrightarrow{{}}$Ba(OH)2 + H2↑
Điều chế kim loại:
$\underbrace{K,Na,Ca,Mg}_{(1)},\underbrace{Al}_{(2)},\underbrace{Zn,Fe,Ni,Sn,Pb,H,Cu,Hg,Ag,Pt,Au}_{(3)}$
(1): Điện phân nóng chảy: $MC{{l}_{n}}\xrightarrow{đpnc}M+\frac{n}{2}C{{l}_{2}}$
(2): Điện phân nóng chảy: $2A{{l}_{2}}{{O}_{3}}\xrightarrow[N{{a}_{3}}Al{{F}_{6}}]{đpnc}4Al+3{{O}_{2}}$
(3): Điện phân dung dịch, thủy luyện, nhiệt luyện
${M_x}{O_y} + \left\{ {\begin{array}{*{20}{c}} C \\ \begin{gathered} CO \hfill \\ {H_2} \hfill \\ Al \hfill \\ \end{gathered} \end{array}} \right.\xrightarrow{{{t^o}}}M + \left\{ {\begin{array}{*{20}{c}} {CO} \\ \begin{gathered} C{O_2} \hfill \\ {H_2}O \hfill \\ A{l_2}{O_3} \hfill \\ \end{gathered} \end{array}} \right.$
Điện phân dung dịch:

Ăn mòn kim loại:
Ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường (quá trình OXH – Khử)
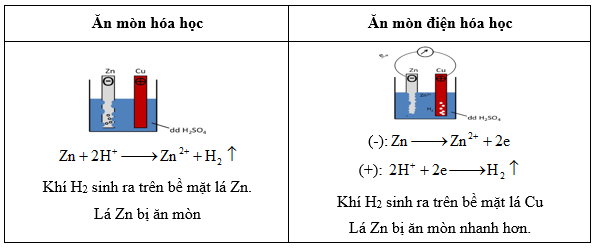
Điều kiện xảy ra ăn mòn điện hóa học:
- Các điện cực khác nhau về bản chất.
- Các điện cực tiếp xúc trực tiếp hoặc gián tiếp.
- Các điện cực cùng tiếp xúc với dung dịch điện ly.
Bảo vệ kim loại:
- Phương pháp bảo vệ bề mặt: sơn, mạ, bôi dầu mỡ…
- Phương pháp điện hóa: dùng kim loại mạnh hơn làm vật hi sinh ví dụ: dùng Zn bảo vệ Fe.
