Lí thuyết về hợp chất của sắt
I. HỢP CHẤT SẮT (II)
- Hợp chất sắt (II) vừa có tính oxi hóa, vừa có tính khử
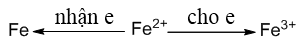
1. Sắt (II) oxit: FeO
- FeO là oxit bazơ: FeO + 2HCl → FeCl2 + H2O
- FeO là chất oxi hóa khi tác dụng với chất khử mạnh như H2, CO, Al,... : FeO + H2 → Fe + H2O
- FeO là chất khử khi tác dụng với các chất oxi hóa mạnh như HNO3, H2SO4 đặc, nóng
FeO $\xrightarrow{HN{{O}_{3}},{{H}_{2}}S{{O}_{4}}\,(d,{{t}^{o}})}$ dung dịch muối Fe3+:
PTHH: 3FeO + 10HNO3 $\xrightarrow{{}}$ 3Fe(NO3)3 + NO + 5H2O
2. Sắt (II) hiđroxit: Fe(OH)2 là chất rắn màu trắng hơi xanh, là bazơ không tan trong nước
- Fe(OH)2 bị oxi hóa trong không khí : Fe(OH)2 + O2 + H2O → Fe(OH)3
(trắng xanh) (nâu đỏ)
- Fe(OH)2 dễ bị nhiệt phân:
+ Trong chân không : Fe(OH)2 $\xrightarrow{{{t}^{o}}}$ FeO + H2O
+ Trong không khí: 4Fe(OH)2 + O2 $\xrightarrow{{{t}^{o}}}$ 2Fe2O3 + 4H2O
3. Muối sắt (II)
- Dễ bị oxi hóa thành muối sắt (III) : Muối Fe2+ $\xrightarrow{oxh}$ muối Fe3+
2FeCl2 + Cl2 $\xrightarrow{{}}$ 2FeCl3
lục nhạt vàng nâu
10FeSO4 + 2KMnO4 + 8H2SO4 $\xrightarrow{{}}$ 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
(dung dịch màu tím hồng) (dung dịch màu vàng)
II. HỢP CHẤT SẮT (III)
- Ion Fe3+ nhận 1 hoặc 3e để trở thành Fe2+ hoặc Fe => tính chất đặc trưng của hợp chất sắt (III) là tính oxi hóa
- Các hợp chất sắt (III) tác dụng với HNO3 hoặc H2SO4 đặc, nóng không sinh ra khí
1. Sắt (III) oxit: Fe2O3
- là chất rắn màu đỏ nâu, không tan trong nước
- là oxit bazơ, dễ tan trong axit mạnh: Fe2O3 + 6HCl → 2FeCl3 + 3H2O
- là chất oxi hóa: Fe2O3 $\xrightarrow{+Al,{{H}_{2}},CO,C}$ Fe
PTHH: Fe2O3 + Al $\xrightarrow{{{t}^{0}}}$ Al2O3 + 2Fe
Muối Fe3+ $\xrightarrow{+Fe(Cu)}$ muối Fe2+ : 2FeCl3 + Fe $\xrightarrow{{}}$ 3FeCl2
2FeCl3 + Cu $\xrightarrow{{}}$ 2FeCl2 + CuCl2
Lưu ý: + Fe3O4 là hỗn hợp FeO và Fe2O3
2. Sắt (III) hiđroxit: Fe(OH)3
- là chất rắn màu nâu đỏ, không tan trong nước.
- là bazơ, dễ tan trong axit mạnh: Fe(OH)3 + 3HCl → FeCl3 + 3H2O
- bị nhiệt phân tạo thành oxit: 2Fe(OH)3 $\xrightarrow{{{t}^{0}}}$ Fe2O3 + 3H2O
3. Muối sắt (III)
- có tính oxi hóa, dễ bị khử thành muối sắt (II)
PTHH: Fe2(SO4)3 + Cu → 2FeSO4 + CuSO4
2FeCl3 + H2S → 2FeCl2 + 2HCl + S
- Các muối sắt (III) bị thủy phân trong môi trường kiềm
PTHH: 2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3 + 6NaCl + 3CO2
