Lí thuyết về sắt
I. VỊ TRÍ VÀ CẤU TẠO
- Cấu hình electron: 1s22s22p63s23p63d64s2
- Sắt là nguyên tố thuộc nhóm VIIIB, chu kì 4, số hiệu nguyên tử là 26
II. TÍNH CHẤT VẬT LÍ
- Sắt là kim loại có màu trắng hơi xám, dẻo, dễ rèn, nóng chảy ở nhiệt độ cao.
- Sắt có tính dẫn điện, dẫn nhiệt tốt, đặc biệt có tính nhiễm từ.
III. TÍNH CHẤT HÓA HỌC
- Tính chất hóa học cơ bản của sắt là tính khử trung bình
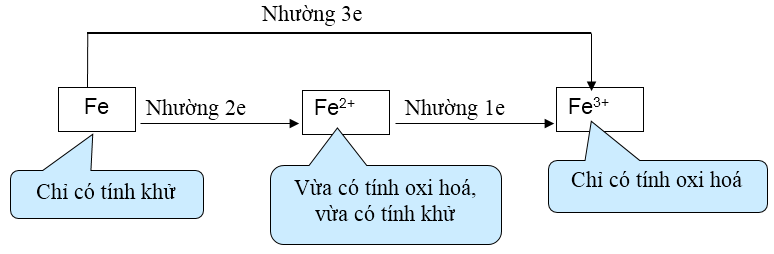
Chú ý dạng câu hỏi lí thuyết: Chất vừa có tính oxi hóa vừa có tính khử, phải xem xét ion Fe3+ (chỉ có tính oxi hóa) và các ion mang điện tích âm (có thể có tính khử). Ví dụ FeCl3 vừa có tính oxi hóa vừa có tính khử.
1. Tác dụng với phi kim
- Với phi kim là chất oxi hóa mạnh như clo, … Fe bị oxi hóa thành Fe3+
2Fe + 3Cl2 $\xrightarrow{{{t}^{o}}}$ 2FeCl3
- Với oxi tạo ra oxit sắt từ (có thể tạo ra hỗn hợp FeO và Fe2O3)
3Fe + 2O2 $\xrightarrow{{{t}^{o}}}$ Fe3O4
- Với phi kim là chất oxi hóa trung bình như S thì Fe bị oxi hóa thành Fe2+
Fe + S $\xrightarrow{{{t}^{o}}}$ FeS
2. Tác dụng với axit
- Fe tác dụng với axit HCl và H2SO4 loãng sinh ra muối Fe2+ và khí H2
Fe + 2HCl → FeCl2 + H2
- Fe tác dụng với axit HNO3 và H2SO4 đặc nóng sinh ra muối Fe3+ và sản phẩm khử
Fe $\xrightarrow{+HN{{O}_{3}},{{H}_{2}}S{{O}_{4}}(,{{t}^{o}})}$ Fe3+ + sp khử của $\overset{+5}{\mathop{N}}\,,\overset{+6}{\mathop{S}}\,$ + H2O (*)
- Đối với phản ứng (*) nếu Fe dư thì : Fe + 2Fe3+ $\to $ 3Fe2+
- Fe thụ động trong HNO3 đặc nguội hoặc H2SO4 đặc nguội
3. Tác dụng với dung dịch muối:
Fe bị oxi hoá thành Fe2+ theo quy tắc α
Fe + CuSO4 → FeSO4 + Cu
Fe + 2AgNO3 $\xrightarrow{{}}$ Fe(NO3)2 + 2Ag (1)
- Nếu Fe dư thì sau phản ứng thu được chất rắn gồm Ag và Fe dư; dung dịch chỉ có Fe(NO3)2
- Nếu AgNO3 dư thì xảy ra phản ứng AgNO3 + Fe(NO3)2 $\xrightarrow{{}}$ Fe(NO3)3 + Ag (2)
$\Rightarrow $sau phản ứng thu được chất rắn chỉ có Ag (1+2) và dung dịch chứa Fe(NO3)3, AgNO3 dư
IV. TRẠNG THÁI TỰ NHIÊN
- Quặng hematit đỏ chứa Fe2O3 khan, quặng hematit nâu chứa Fe2O3.nH2O
- Quặng manhetit chứa Fe3O4 là quặng giàu sắt nhất.
- Quặng xiđerit chứa FeCO3, quặng pirit chứa FeS2.
