Đề thi HK1 môn Hóa 10 năm 2020 - Trường THPT Trần Hưng Đạo
-
Hocon247
-
40 câu hỏi
-
60 phút
-
67 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Số oxi hóa của Mn trong ion MnO4- bằng bao nhiêu?
Gọi số oxi hóa của Mn là x, ta có :
1.x + 4.( –2) = –1 => x = +7. Vậy số oxi hóa của Mn là +7.
Hóa trị và số oxi hóa của N trong phân tử HNO3 lần lượt là gì?
Trong phân tử HNO3 thì N có hóa trị 4
Gọi x là số OXH của N có trong phân tử HNO3
→ 1 + x + 3 * (-2) = 0 → x = +5
Số OXH của N có trong phân tử HNO3 là +5
Hòa tan 1 hỗn hợp 14,5 gam (Fe, Mg, Zn) bằng dung dịch HCl vừa đủ thì thu được dung dịch X có chứa 35,8 gam muối. Tính thể tích khí H2 thu được sau phản ứng.
Áp dụng định luật bảo toàn khối lượng ta có:
m KL + m Cl- = m Muối
→ mCl- = 35,8 – 14,5 = 21,3 (gam)
→ nCl- = 21,3 : 35,5 = 0,6 (mol)
→ Số mol e nhường = nCl- = 0,6 (mol)
→ nH2 = 0,6 : 2 = 0,3 (mol)
V H2 = 0,3 * 22.4 = 6,72 (lít)
Cho 5 gam Mg, Zn vào dung dịch HCl dư thu được 3,136 lít H2. Số mol Mg thu được là?
Gọi số mol Mg, Zn lần lượt a, b mol
n H2 = 3,136 : 22,4 = 0,14 mol
Khối lượng của kim loại nặng 5 gam
→ 24 a + 65 b = 5 (I)
Ta có quá trình nhường nhận e như sau:
|
Quá trình OXH Mg → Mg+2 + 2e a 2a Zn → Zn+2 + 2e b 2b |
Qúa trình Khử 2H+ + 2e → H2 0,28 0,14 |
Từ (I) và (II) → a = 0,1 mol ; b = 0,04 mol
Vậy số mol Mg có trong hỗn hợp là 0,1 mol
Cho 9,32 gam Mg và Zn vào 200 ml dung dịch H2SO4 2M. Hãy cho biết kết luận nào sau đây đúng?
n H2SO4 = 0,4 mol.
Gỉa sử H2SO4 phản ứng hết → n e trao đổi = nH+ = 0,8 mol
→ n hh kim loại = 0,8 : 2 = 0,4 (mol)
Mặt khác 9,32 : 24 > n hh > 9,32 : 65
→ 0,39 > nHH > 0,14
Mà 0,4 > 0,39
→ Sau phản ứng axit còn dư, kim loại tan hết.
Cho 13,5 gam nhôm tác dụng vừa đủ với 2,5 lít dung dịch HNO3, phản ứng tạo ra muối nhôm và một hỗn hợp khí gồm NO và N2O có tỉ lệ mol tương ứng là 2: 3. Tính nồng độ mol của dung dịch HNO3?
Gọi n NO, n N2O lần lượt là 2a, 3a mol
Ta có: n Al = 13,5 : 27 = 0,5 (mol)
Áp dụng định luật bảo toàn electron ta có:
|
Qúa trình OXH Al → Al+3 + 3e 0,5 1,5 (mol) |
Qúa trình khử N+5 + 3e → N+2 6a 2a 2N+5 +8e → 2N+1 24a 3a |
Áp dụng định luật bảo toàn electron
→ 1,5 = 6a + 24a → 30a = 1,5 → a = 0,05 (mol)
nNO = 0,1 mol; nN2O = 0,15 mol
→ nHNO3 = 4 * nNO + 10 * nN2O = 0,1 * 4 + 0,15 * 10 = 1,9 mol
CM HNO3 = 1,9 : 2,5 = 0,76M
Đáp án C
Hòa tan hoàn toàn 6,5 gam kim loại Zn vào dung dịch HNO3 loãng, giả sử chỉ thu được 0,448 lít khí X duy nhất (đktc). Khí X là gì?
n Zn = 6,5 : 65 = 0,1 mol
n X = 0,448 : 22,4 = 0,02 (mol)
n e nhường = 2 * n Zn = 0,2 (mol)
→ 0,02 mol X nhận 0,2 mol e
→ 1 mol X nhận 10 mol e
Vậy X là khí N2.
Hòa tan 8,4 gam Fe trong dung dịch HNO3 dư, tính thể tích khí NO bay ra, biết NO là sản phẩm khử duy nhất của HNO3?
n Fe = 8,4 : 56 = 0,15 (mol)
Ta có quá trình trao đổi electron như sau:
Fe → Fe+3 + 3e
0,15 0,45
N+5 +3e → N+2
Áp dụng đinh luật bảo toàn electron n e nhận = n e nhường = 0,45 mol
→ nNO = 1/3 n e nhận = 0,45 : 3 = 0,15 mol
V NO = 0,15 * 22, 4 = 3,36 lít
Nung m gam bột sắt trong oxi, thu được 3 gam hỗn hợp chất rắn X. Hòa tan hoàn toàn hỗn hợp X trong dung dịch HNO3 (dư), thoát ra 0,56 lít (đktc) NO (là sản phẩm khử duy nhất). Giá trị của m là?
n NO = 0,56 : 22,4 = 0,025 mol
Xét 3 gam hỗn hợp chất rắn X. Đặt số mol Fe, O lần lượt là a, b
→ 56a + 16b = 3 (I)
Áp dụng định luật bảo toàn electron:
→ 3 * nFe = 2 * n O + 3 * n NO
→ 3a = 2*b + 3 * 0,025
→ 3a – 2b = 0,075 (II)
Từ (I) và (II) → a = 0,045; b = 0,03
→ m = n Fe * 56 = 0,045 * 56 = 2,52 (gam)
Nung hỗn hợp X gồm 13,44 gam Fe và 7,02 gam Al trong không khí một thời gian, thu được 28,46 gam chất rắn Y. Cho Y tác dụng với dung dịch H2SO4 đặc, nóng dư, thu được V lít khí SO2 (đktc). Giá trị của V là bao nhiêu?
n Fe = 13,44 : 56 = 0,24 (mol)
n Al = 7,02 : 27 = 0,26 (mol)
Áp dụng định luật bảo toàn khối lượng
→ m KL + m O = m Y
→ m O = 28,46 – 13,44 – 7,02 = 8 (gam)
→ n O = 8 : 16 = 0,5 (mol)
Áp dụng định luật bảo toàn electron ta có:
3 * n Fe + 3 * n Al = 2 * n O + 2 * n SO2
→ n SO2 = 0,25 (mol)
→ V SO2 = 0,25 * 22,4 = 5,6 lít
Phản ứng nhiệt phân muối thuộc phản ứng nào?
Phản ứng nhiệt phân muối thuộc loại phản ứng phân hủy nên nó có thể là phản ứng OXH khử hoặc không
Đáp án C
Phản ứng nào sau đây vừa là phản ứng hóa hợp, vừa là phản ứng oxi hóa – khử?
Đáp án A và B không có sự thay đổi số oxi hóa → không phải là phản ứng oxi hóa khử.
C là phản ứng thế (loại)
Đáp án D.
Phản ứng nào sau đây là phản ứng thế?
Phản ứng thế là phản ứng giữa đơn chất và hợp chất. Sau phản ứng sinh ra đơn chất và hợp chất mới.
Đáp án B
Cho từng chất : Fe, FeO, Fe(OH)2, Fe3O4, Fe2O3, Fe(NO3)3, Fe(NO3)2, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc nóng. Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử là bao nhiêu?
Phản ứng OXH – Khử xảy ra khi có sự thay đổi số OXH của chất tham gia sau phản ứng.
HNO3 luôn là chất OXH, nên tác nhân phản ứng còn lại phải đóng vai trò là chất khử.
Chất khử là chất có OXH tăng lên sau phản ứng. Vậy chất có khả năng đóng vai trò chất khử khi tham gia phản ứng là chất có thể tăng được số OXH
→ Các chất có khả năng tạo được phản ứng OXH – Khử với HNO3 là: Fe, FeO, Fe(OH)2, Fe3O4, Fe(NO3)3, Fe(NO3)2, FeSO4, FeCO3
Loại những hợp chất: Fe2O3, Fe(NO3)3, Fe2(SO4)3
(Do số OXH của Fe trong những hợp chất này là +3 (max) nên không thể tham gia khử được nữa)
Cho các phản ứng sau :
a. FeO + H2SO4 đặc nóng →
b. FeS + H2SO4 đặc nóng →
c. Al2O3 + HNO3 →
d. Cu + Fe2(SO4)3 →
e. RCHO + H2 \(\xrightarrow{Ni,{{t}^{o}}}\)
f. Glucozơ + AgNO3 + NH3 + H2O→
g. Etilen + Br2 →
h. Glixerol + Cu(OH)2 →
Dãy gồm các phản ứng đều thuộc loại phản ứng oxi hoá – khử là ?
(a) \(2\mathop {Fe}\limits^{ + 2} O + 4{H_2}\mathop S\limits^{ + 6} {O_4} \to {\mathop {Fe}\limits^{ + 3} _2}{(S{O_4})_3} + \mathop S\limits^{ + 4} {O_2} + 4{H_2}O\)
→ Phản ứng OXH – Khử
(b) \(2\mathop {FeS}\limits^0 + 10{H_2}\mathop S\limits^{ + 6} {O_4} \to {\mathop {Fe}\limits^{ + 3} _2}{(S{O_4})_3} + 9\mathop S\limits^{ + 4} {O_2} + 10{H_2}O\)
→ Phản ứng OXH – Khử
(c) Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O
→ Không phải là phản ứng OXH – Khử
(d) \(\mathop {Cu}\limits^0 + {\mathop {Fe}\limits^{ + 3} _2}{(S{O_4})_3} \to \mathop {Cu}\limits^{ + 2} S{O_4} + 2\mathop {Fe}\limits^{ + 2} S{O_4}\)
→ Phản ứng OXH – Khử
(e) .\(R\overset{+1}{\mathop{C}}\,HO+\overset{0}{\mathop{{{H}_{2}}}}\,\xrightarrow{Ni,{{t}^{0}}}R\overset{-1}{\mathop{C}}\,{{H}_{2}}O\overset{+1}{\mathop{H}}\,\)
→ Phản ứng OXH – Khử
(f) \({C_5}{H_{11}}{O_5}\mathop C\limits^{ - 1} HO + 2\mathop {Ag}\limits^{ + 1} N{O_3} + 3N{H_3} + {H_2}O \to \)
\({C_5}{H_{11}}{O_5}\mathop C\limits^{ + 3} OON{H_4} + 2\mathop {Ag}\limits^0 + 2N{H_4}N{O_3}\)
→ Phản ứng OXH – Khử
(g) \(\mathop C\limits^{ - 2} {H_2} = C{H_2} + {\mathop {Br}\limits^0 _2} \to \mathop C\limits^{ - 1} {H_2}\mathop {Br}\limits^{ - 1} - C{H_2}Br\)
→ Phản ứng OXH – Khử
(h) 2 C3H8O3 + Cu(OH)2 → (C3H7O3)2Cu + 2H2O
→ Không phải phản ứng OXH – Khử
Đáp án B
Bo là nguyên tố dinh dưỡng thiết yếu đối với cây trồng. Ngày nay trên 70 quốc gia đã phát hiện tình trạng thiếu Bo ở hầu hết các loại cây trên nhiều loại đất. Phân bón Bo cũng đã được sử dụng rộng rãi trên thế giới. Trong tự nhiện, Bo có 2 đồng vị. Biết \({}_5^{10}B\) chiếm 18,8%. Khối lượng nguyên tử trung bình của Bo là 10,812. Số khối của đồng vị thứ 2 là bao nhiêu?
Gọi số khối của đồng vị thứ 2 là A
→ Phần trăm của đồng vị là: 100 – 18,8 = 81,2%
\( \Rightarrow \overline {{M_B}} = \dfrac{{18,8.10 + 81,2.A}}{{100}} = 10,812 \)
→ A = 11
Đáp án D
Hòa tan m gam Al vào dung dịch HNO3 rất loãng chỉ thu được hỗn hợp khí gồm 0,03 mol N2O và 0,01 mol NO. Giá trị của m là?
Các quá trình xảy ra:
\(\eqalign{ & Al \to A{l^{3 + }} + 3e\;\;\;\;\;{\rm{ 2}}{{\rm{N}}^{ + 5}} + 8e \to {N_2}^{ + 1} \cr & \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{ 0,24}} \leftarrow {\rm{0,03mol}} \cr & {\rm{ }}{{\rm{N}}^{ + 5}} + 3e \to {N^{ + 2}} \cr & \;\;\;\;\;\;\;{\rm{ 0,03}} \leftarrow {\rm{0,01mol}} \cr} \)
Áp dụng định luật bảo toàn electron ta có: ne nhường = ne nhận
\(\eqalign{ & \Rightarrow {n_{Al}} = {{0,24 + 0,03} \over 3} = 0,09\left( {mol} \right) \cr & \to {m_{Al}} = n.M = 0,09.27 = 2,43gam \cr} \)
Nguyên tố Y là phi kim thuộc chu kì 3 của bảng tuần hoàn, Y tạo được hợp chất khí với hiđro và công thức oxit cao nhất là YO3. Nguyên tố Y tạo với kim loại M cho hợp chất có công thức MY2, trong đó M chiếm 46,67 % về khối lượng. M là chất nào?
Công thức oxit cao nhất là YO3 nên hóa trị của Y trong công thức oxit cao nhất là 6
Trong MS2, M chiếm 46,67% về khối lượng
\( \Rightarrow 46,67 = \dfrac{M}{{M + 2.32}}.100 \Rightarrow M = 56\)
Vậy kim loại M cần tìm là Fe
Phản ứng oxi hóa – khử là một trong những quá trình quan trọng nhất của thiên nhiên. Sự hô hấp, quá trình thực vật hấp thụ khí cacbonic giải phóng oxi, sự trao đổi chất và hang loạt quá trình sinh học khác đều có cơ sở là phản ứng oxi hóa- khử. Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các quá trình xảy ra trong pin, acquy đều bao gồm sự oxi hóa và sự khử. Hàng loạt quá trình sản xuất như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học... đều không thực hiện được nếu thiếu các phản ứng oxi hóa – khử. Đặc điểm của phản ứng oxi hóa – khử là gì?
Đặc điểm của phản ứng oxi hóa khử là xảy ra đồng thời hai quá trình nhường và nhận electron.
A.có một nguyên tố thay đổi số oxi hóa: Sai, vì trong phản ứng oxi hóa khử có thể có nhiều nguyên tố thay đổi số oxi hóa.
B.xảy ra đồng thời hai quá trình nhường và nhận electron: Đúng.
C.chất khử và chất oxi hóa là các chất riêng biết: Sai, vì một chất có thể vừa là chất khử vừa là chất oxi hóa.
D.luôn có một chất đóng vai trò là môi trường: Sai, vì có phản ứng oxi hóa khử không có môi trường.
Đáp án B
Cho các nhận định sau đây:
(1) Trong cùng chu kì, theo chiều tăng điện tích hạt nhân, bán kính nguyên tử giảm, tính phi kim tăng.
(2) Trong cùng một nhóm chính, theo chiều tăng tính kim loại, độ âm điện của nguyên tố tăng.
(3) Trong một nhóm chính, theo chiều tăng ban kính nguyên tử, khả năng nhường electron tăng dần.
(4) Trong một chu kì , hóa trị của nguyên tố trong hợp chất khí với hiđro giả, dần từ 4 đến 1.
(5) Trong chu kì hóa trị của các nguyên tố trong oxit cao nhất biến đổi tuần hoàn từ 1 đến 7.
(6) Trong một nhóm chính, theo chiều tăng điện tích hạt nhân, tính kim loại giảm dần đồng thời tính phi kim tăng dần.
Số nhận định đúng là?
(1) Trong cùng chu kì, theo chiều tăng điện tích hạt nhân, bán kính nguyên tử giảm, tính phi kim tăng: Đúng.
(2) Trong cùng một nhóm chính, theo chiều tăng tính kim loại, độ âm điện của nguyên tố tăng: Sai.
(3) Trong một nhóm chính, theo chiều tăng ban kính nguyên tử, khả năng nhường electron tăng dần: Đúng, vì tính kim loại tăng suy ra khả năng nhường electron cũng tăng.
(4) Trong một chu kì, hóa trị của nguyên tố trong hợp chất khí với hiđro giả, dần từ 4 đến 1: Đúng.
(5) Trong chu kì hóa trị của các nguyên tố trong oxit cao nhất biến đổi tuần hoàn từ 1 đến 7: Đúng.
(6) Trong một nhóm chính, theo chiều tăng điện tích hạt nhân, tính kim loại giảm dần đồng thời tính phi kim tăng dần: Sai.
Đáp án B
Hòa tan hoàn toàn 18,4 gam hỗn hợp hai muối cacbonat của hai kim loại X, Y thuộc nhóm IIA và thuộc hai chu kì liên tiếp bằng dung dịch HCl thu được 4,48 lít CO2 (đktc). Hai kim loại X, Y là gì?
Gọi công thức chung của hai muối cacbonat là ACO3.
Phương trình hóa học
\(\eqalign{ & {\rm{ }}\overline A C{O_3} + 2HCl \to \overline A C{l_2} + {H_2}O + C{O_2} \cr & {n_{\overline A C{O_3}}} = {n_{C{O_2}}} = {V \over {22,4}} = {{4,48} \over {22,4}} = 0,2mol \cr & \Rightarrow {M_{\overline A C{O_3}}} = {m \over n} = {{18,4} \over {0,2}} = 92 \cr & \Rightarrow {M_{\overline A }} = 92 - 60 = 32 \cr} \)
Vậy MX < 32 < MY, X,Y thuộc hai chu kì liên tiếp, thuộc nhóm IIA nên 2 nguyên tố cần tìm là Mg(M=24) và Ca(M=40)
Đáp án C
Quá trình oxi hóa xảy ra trong phản ứng: \(Fe + CuS{O_4} \to FeS{O_4} + Cu\) là?
\(Fe + CuS{O_4} \to FeS{O_4} + Cu\)
Quá trình oxi hóa tương ứng với chất khử đó là quá trình nhường electron
Trong phản ứng trên: Fe là chất khử, CuSO4 là chất oxi hóa.
Quá trình oxi hóa: \(Fe \to F{e^{2 + }} + 2e\)
Đáp án A
Chọn phát biểu không đúng trong các câu sau đây?
A. Chất oxi hóa là chất nhận electron và số oxi háo giảm sau phản ứng: Đúng.
B. Cho các nguyên tố sau: 11X, 11Y, 13Z. Sắp xếp theo chiều tang dần tính kim loại là: Y < X < Z: Sai, vì X, Y, Z thuộc cùng một chu kì nên tính kim loại tăng dần theo dãy Z < X < Y.
C. Tất cả các nguyên tố khí hiếm đều có cấu hình electron lớp ngoài cùng là 8e ( trừ He ): Đúng.
D. Trong phản ứng: \(C{l_2} + KOH \to KCl + KCl{O_3} + {H_2}O\) , tỉ lệ giữa số nguyên tử clo đóng vai trò chất oxi hóa và số nguyên tử clo dóng vai trò chất khử là 1:5: Đúng.
Đáp án B
Ion X3- có cấu hình electron lớp ngoài cùng là: 3s23p6. Thành phần phần trăm về khối lượng của X trong hidroxit cao nhất là bao nhiêu?
Cấu hình electron của X3- là 1s22s22p63s23s23p6 nên cấu hình electron của X là 1s22s22p63s23p3
X có Z=15 nên nguyên tố P \( \Rightarrow \) công thức oxit cao nhất là P2O5
Công thức hiđroxit cao nhất là \({H_3}P{O_4} \)
\( \Rightarrow \% P = \dfrac{{31}}{{3 + 31 + 16.4}}.100 = 31,63\% \)
Nhận xét nào dưới đây không đúng về các nguyên tố nhóm VIIIA?
A.Lớp electron ngoài cùng đã bão hào, bền vững: Đúng.
B.Hầu như trơ, không tham gia phản ứng hóa học ở điều kiện thường: Đúng.
C.Nhóm VIIIA dọi là nhóm khí hiếm: Đúng.
D.Nguyên tử của chúng luôn có 8 electron lớp ngoài cùng: Sai, vì He cũng là nguyên tố khí hiếm nhưng chỉ có 2 electron ở lớp ngoài cùng.
Nguyên tử của nguyên tố X có 11 proton, nguyên tố Y có số hiệu nguyên tử là 8. Nguyên tố X khi tạo thành liên kết hóa học với nguyên tố Y thì nguyên tử Y sẽ?
X có 11 proton nên tổng số electron của X là 11
Cấu hình electron của X là 1s22s22p63s1
Lớp ngoài cùng có 1 electron nên X là kim loại dễ nhường đi electron \(X \to {X^ + } + 1e\)
Y (Z=8): 1s22s22p4
Lớp ngoài cùng có 6 electron \( \to \) Y là phi kim, dễ nhận thêm 2 electron khi hình thành liên kết với các kim loại
\(Y + 2e \to {Y^{2 - }}\)
Liên kết được hình thành giữa X và Y thuộc hóa trị liên kết ion. Liên kết này được hình thành bằng lực hút tĩnh điện của các ion X+ và Y2-. Vậy Y phải nhận thêm 2 electron để tạo thành ion có điện tích là 2-.
Đáp án A
Cho sơ đồ: \(Fe \to F{e^{3 + }} + 3e.\) Sơ đồ trên biểu diễn quá trình nào?
Cho sơ đồ: \(Fe \to F{e^{3 + }} + 3e.\) Sơ đồ trên biểu diễn quá trình quá trình oxi hóa.
Cation R+ có cấu tạo như hình vẽ. Vị trí của R trong bảng tuần hoàn là gì?
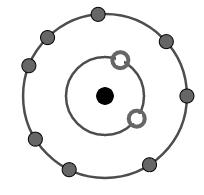
Từ hình ảnh về sự sắp xếp các electron của ion R+ ta thấy:
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 8 electron.
Do vậy cấu hình electron của ion R+ là: 1s22s22p6.
\(\eqalign{ & {\rm{ R}} \to {\rm{1e + }}{{\rm{R}}^ + } \cr & 1{s^2}2{s^2}2{p^6}3{s^1}{\rm{ }} \leftarrow {\rm{ }}1{s^2}2{s^2}2{p^6} \cr} \)
Vị trí của R: chu kì 3 (do có 3 lớp electron); nhóm IA (do có 1 electron ở lớp ngoài cùng và là nguyên tố s)
Đáp án B
Nước đá khô thường được dùng để làm lạnh, giữ lạnh nhằm vận chuyển và bảo quản các sản phẩm dễ hư hỏng vì nhiệt độ. Nước đá khô được dùng nhiều trong các ngành công nghiệp thực phẩm, thủy hải sản và còn được dùng để bảo quản vắc xin, dược phẩm trong ngành y tế - dược phẩm. Thành phần chính của nước đá khô là CO2, hãy chỉ ra nhận định sai trong các câu sau:
Công thức electron của phân tử CO2 O : : C : : O
Công thức cấu tạo O = C = O
Vậy: + Trong phân tử có hai liên kết đôi
+ \({\chi _O} > {\chi _C}\) nên liên kết giữa nguyên tử O và C là liên kết cộng hóa trị phân cực.
Tuy nhiên phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết đôi (C=O)
Triệt tiêu nhau kết quả là toàn bộ phân tử không bị phân cực.
Đáp án D
Cho các phát biểu sau:
1.Số proton trong hạt nhân nguyên tử bằng số electron ở vỏ nguyên tử.
2.Trong hạt nhân nguyên tử, số proton bằng số nơtron.
3.Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử.
4.Chỉ có hạt nhân nguyên tử lưu huỳnh mới có 16 nơtron.
Các phát biểu đúng là
1.Số proton trong hạt nhân nguyên tử bằng số electron ở vỏ nguyên tử: Đúng.
2.Trong hạt nhân nguyên tử, số proton bằng số nơtron: Sai, vì khong tất cả các nguyên tử của các nguyên tố đều có số proton bằng nơtron.
3.Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử: Đúng.
4.Chỉ có hạt nhân nguyên tử lưu huỳnh mới có 16 nơtron: Sai, vì một nguyên tử khác cũng có 16 nơtron như photpho...
Đáp án B
Nguyên tố hóa học A có số hiệu nguyên tử là 20, chu kì 4, nhóm IIA. Điều nhận xét nào sau đây là sai?
Số hiệu nguyên tử là 20\( \Rightarrow \) có 20 electron.
Chu kì 4 \( \Rightarrow \) có 4 lớp electron.
Nhóm IIA \( \Rightarrow \) có 2 electron ở lớp ngoài cùng.
Vậy cấu hình electron của A là: 1s22s22p63s23p64s2
Các nhận xét
A.Số electron ở lớp vỏ của nguyên tử nguyên tố A là 20: Đúng.
B.Lớp vỏ của nguyên tử nguyên tố A có 4 lớp electron và lớp ngoài cùng có 2 electron: Đúng.
C.Hạt nhân nguyên tử của nguyên tố A có 20 proton: Đúng.
D.Nguyên tố hóa học này là một phi kim: Sai, vì có 2 electron lớp ngoài cùng nên A là nguyên tố kim loại
Đáp án D
Cho X, Y, R, T là nguyên tố khác nhau tron số bốn nguyên tố: 12Mg, 13Al, 19K, 20Ca và các chất được ghi trong bảng sau:
+ Mg, Al cùng thuộc chu kì 3 của bảng tuần hoàn \( \Rightarrow \) bán kính nguyên tử Mg > Al. (1)
+ K, Ca cùng thuộc chu kì 4 của bảng toàn hoàn\( \Rightarrow \) bán kính nguyên tử K > Ca. (2)
+ Mg, Ca cùng thuộc nhóm IIA của bảng tuần hoàn\( \Rightarrow \) bán kính nguyên tử của Mg < Ca. (3)
Từ (1), (2), (3) \( \Rightarrow \) bán kính nguyên tử sắp xếp theo độ tăng dần là: Al < Mg < Ca < K
Đáp án B
Cho Mg (Z=12), Al (Z=13), K (Z=19), Ca (Z=20). Tính bazo của các hiđroxit nào sau đây lớn nhất?
+ Mg, Al cùng thuộc chu kì 3\( \Rightarrow \) tính kim loại của Mg > Al. (1)
+ K, Ca cùng thuộc chu kì 4\( \Rightarrow \) tính kim loại của K > Ca. (2)
+ Mg, Ca cùng thuộc nhóm IIA\( \Rightarrow \) tính kim loại của Mg < Ca. (3)
Từ (1), (2), (3) \( \Rightarrow \) tính kim loại sắp xếp theo thứ tự tăng dần là: Al < Mg < Ca < K.
Do vậy tính bazơ của hiđroxit cũng tăng theo thứ tự
\(Al{\left( {OH} \right)_3} + Mg{\left( {OH} \right)_2} < Ca{\left( {OH} \right)_2} < KOH\)
Đáp án A
Phát biểu nào dưới đây là đúng?
A. Electron ở phân lớp 4p có mức năng lượng thấp hơn phân lớp 4s: Sai, vì mức năng lượng của phân lớp 4p cao hơn phân lớp 4s.
B. Những electron ở gần hạt nhân có mức năng lượng cao nhất: Sai, vì electron càng ở gần hạt nhân thì mức năng lượng càng thấp.
C. Các electron trong cùng một lớp có năng lượng bằng nhau: Sai, vì các electron trong cùng một lớp có mức năng lượng gần bằng nhau.
D. Những electron ở lớp K có mức năng lượng thấp nhất: Đúng.
Đáp án D
Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hóa trị cao nhất thì oxi chiếm 74,07% về khối lượng. Nguyên tố R là gì?
Công thức hợp chất khí tạo bởi R và hiđro là RH3 nên công thức oxit cao nhất của R là R2O5.
\(\% O = \dfrac{{5.16}}{{2.{M_R} + 5.16}}.100 \Rightarrow {M_R} = 4\)
Cho 8,3 gam Al và Fe tác dụng với HNO3 thu được 13,44 lít khí NO2 (đktc). Thành phần phần trăm về khối lượng của Al trong hỗn hợp là bao nhiêu?
\({n_{N{O_2}}} = \dfrac{V}{{22,4}} = \dfrac{{13,44}}{{22,4}} = 0,6\left( {mol} \right)\)
Gọi x, y lần lượt là số mol của Al và Fe trong hỗn hợp.
Các quá trình xảy ra:
\(\eqalign{ & Al \to A{l^{3 + }} + 3e{\rm{ }}\;\;\;\;\;\;\;{{\rm{N}}^{ + 5}} + 1e \to {N^{ + 4}} \cr & x{\rm{ }} \to\;\;\;\;\;\;\;\;\;\; {\rm{ 3x mol }} \;\;\;\;\;\;\;\;\;\;\;\;\;0,6\leftarrow {\rm{0,6 mol}} \cr & {\rm{Fe}} \to {\rm{F}}{{\rm{e}}^{3 + }} + 3e \cr & y{\rm{ }} \to \;\;\;\;\;\;\;\;\;\;{\rm{ 3y mol}} \cr} \)
Áp dụng định luật bảo toàn electron ta có: 3x + 3y = 0,6 (1)
Mặt khác \({m_{hh}} = {m_{Al}} + {m_{Fe}} \)
\(\Rightarrow 27x + 56y = 8,3\left( 2 \right)\)
Từ (1) và (2) ta có:
\(\eqalign{ & \left\{ \matrix{ 3x + 3y = 0,6 \hfill \cr 27x + 56y = 8,3 \hfill \cr} \right. \Leftrightarrow \left\{ \matrix{ x = 0,1 \hfill \cr y = 0,1 \hfill \cr} \right. \cr & \Rightarrow \left\{ \matrix{ {m_{Al}} = 0,1.27 = 2,7\left( {gam} \right) \hfill \cr {m_{Fe}} = 0,1.56 = 5,6\left( {gam} \right) \hfill \cr} \right. \cr & \to \% {m_{Al}} = {{2,7} \over {8,3}}.100 = 32,53\% \cr} \)
Cho 2 gam một kim loại nhóm IIA tác dụng với dung dịch HCl tạo ra 5,55 gam muối clorua. Kim loại đó là gì?
Gọi kim loại cần tìm là M. Vì M thuộc nhóm IIA nên M có hóa trị II.
Phương trình hóa học:
\(M + 2HCl \to MC{l_2} + {H_2}\)
1mol M phản ứng tạo thành 1 mol muối MCl2 có khối lượng tăng là: \(\Delta m = 71\left( {gam} \right)\)
X mol M phản ứng tạo thành x mol MCl2 có khối lượng tăng lên là: 5,55 – 2 = 3,55(gam)
Vậy
\(\eqalign{ & x = {{3,55} \over {71}} = 0,05\left( {mol} \right) \cr & \Rightarrow M = {m \over n} = {2 \over {0,05}} = 40\left( {g/mol} \right) \cr} \)
Nguyên tố cần tìm là Ca
Đáp án C
Cho phản ứng hóa học sau: \(S{O_2} + C{l_2} + 2{H_2}O \to {H_2}S{O_4} + 2HCl.\)
Nhận xét đúng về vai trò của các chất tham gia phản ứng trên?
\(S{O_2} + C{l_2} + 2{H_2}O \to {H_2}S{O_4} + 2HCl\)
Trong phản ứng trên:
+ số oxi hóa của S tăng lên từ +4 (trong SO2) \( \to \) +6 (trong H2SO4) nên SO2 đóng vai trò là chất khử.
+ số oxi hóa của clo giảm từ 0 (trong Cl2) \( \to \) -1 (trong HCl) nên Cl2 đóng vai trò là chất oxi hóa.
Đáp án D
Trong tự nhiên clo có hai đồng vị bền \({}_{17}^{37}Cl,{}_{17}^{35}Cl\) . Nguyên tử khối trung bình của clo là 35,5. Thành phần trăm về khối lượng của 35Cl trong muối kali clorat KClO3 là bao nhiêu?
Gọi x, y lần lượt là thành phần phần trăm của các đồng vị 37Cl và 35Cl \( \Rightarrow x + y = 100\left( 1 \right)\)
Ta có: \(\overline {{M_{Cl}}} = \dfrac{{37.x + 35.y}}{{x + y}}\)
\(\Rightarrow 35,5.100 = 37x + 35y\left( 2 \right)\)
Từ (1) và (2) \( \Rightarrow x = 25,y = 75\)
Thành phần phần trăm của clo trong hợp chất KClO3 là
\(\% Cl = \dfrac{{35,5}}{{39 + 35,5 + 16.3}}.100 = 28,98\% {\text{ }}\)
Vậy thành phần phần trăm của 35Cl trong muối KClO3 là
\({\% ^{35}}Cl = \dfrac{{75.28,9}}{{100}} = 21,74\)
Đáp án B.
Ngâm một vật bằng đồng có khối lượng 4,24 gam vào 80 ml dung dịch AgNO3 CM. Phản ứng kết thúc lấy vật đồng ra khỏi dung dịch, rửa nhẹ, sấy khô; cân nặng 5 gam. Tính CM.
m KL tăng = 5 – 4,24 = 0,76 gam
PTHH:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
PƯ: 1 2 1 2 (mol)
→ m KL tăng = 108.2 – 64 = 152 (g)
ĐB: 0,005 ← 0,01 ← 0,005 ← 0,01
→ m KL tăng = 0,76 (g)
→ CM dd AgNO3 = n/V = 0,01 : 0,08 = 0,125M

