Đề thi giữa HK2 môn Hóa học 12 năm 2021 - Trường THPT Hoàng Văn Thụ
Đề thi giữa HK2 môn Hóa học 12 năm 2021 - Trường THPT Hoàng Văn Thụ
-
Hocon247
-
40 câu hỏi
-
60 phút
-
202 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Thủy phân hợp chất: H2N-CH(CH3)-CONH-CH2-CONH-CH2-CH2-CONH-CH(C6H5)-CONH-CH(CH3)-COOH thì số α-amino axit thu được là
Thủy phân hợp chất trên sẽ thu được các amino axit sau:
H2N-CH(CH3)-COOH (α-amino axit)
NH2-CH2-COOH (α-amino axit)
NH2-CH2-CH2-COOH (không phải α-amino axit)
NH2-CH(C6H5)-COOH (α-amino axit)
Vậy thủy phân hợp chất trên thu được 3 α-amino axit.
Đáp án D
Cho 1 mol X tác dụng tối đa 1 mol Br2. X có thể là chất nào sau đây?
Metan (CH4) là hiđrocacbon no ⟹ không tác dụng với Br2.
Buta-1,3-đien (CH3-CH=CH-CH3) có 2 liên kết đôi C=C ⟹ tác dụng với Br2 theo tỉ lệ 1:2.
Etilen (CH2=CH2) có 1 liên kết đôi C=C ⟹ tác dụng với Br2 theo tỉ lệ 1:1.
Axetilen (CH≡CH) có 1 liên kết ba C≡C ⟹ tác dụng với Br2 theo tỉ lệ 1:2.
Vậy X có thể là etilen.
Đáp án C
Loại tơ nào sau đây có nguồn gốc từ xenlulozơ?
Tơ visco có nguồn gốc từ xenlulozơ.
Đáp án A
Cho a gam hỗn hợp X gồm glyxin, alanin và valin phản ứng với 100 ml dung dịch HCl 1M thu được dung dịch Y. Để phản ứng hết với các chất trong dung dịch Y cần 380 ml dung dịch KOH 0,5M. Mặt khác, đốt cháy hoàn toàn a gam hỗn hợp X rồi cho sản phẩm cháy vào bình đựng dung dịch Ba(OH)2 dư, sau phản ứng khối lượng dung dịch trong bình giảm 43,74 gam. Giá trị của a là
- Để đơn giản hóa, coi dung dịch Y gồm các amino axit và HCl
⟹ nKOH = nHCl + nCOOH
⟹ nCOOH = nKOH - nHCl = 0,38.0,5 - 0,1.1 = 0,09 mol.
Các chất trong X chứa 1 nhóm COOH ⟹ nX = nCOOH = 0,09 mol
- Công thức chung của hỗn hợp X là: CnH2n+1NO2
CnH2n+1NO2 (X) + O2 \(\xrightarrow{{{t}^{o}}}\) nCO2 + H2O + ½ N2
Từ PT phản ứng cháy ⟹ nX = (nH2O - nCO2)/0,5
Đặt nCO2 = x mol; nH2O = y mol
⟹ (y - x)/0,5 = 0,09 ⟹ y - x = 0,045 (1)
- Cho sản phẩm cháy vào bình đựng Ba(OH)2 dư:
CO2 + Ba(OH)2 → BaCO3 ↓ + H2O
x → x (mol)
mdd giảm = m ↓ - mCO2 - mH2O = 43,74 g.
⟹ 197x - 44x - 18y = 43,74
⟹ 153x - 18y = 43,74 (2)
Từ (1)(2) ⟹ x = 0,33; y = 0,375
⟹ nC = nCO2 = 0,33 mol
nH = 2nH2O = 2.0,375 = 0,75 mol
nO = 2nCOOH = 2.0,09 = 0,18 mol
nN = nX = 2.0,045 = 0,09 mol
⟹ a = 0,33.12 + 0,75 + 0,18.16 + 0,09.14 = 8,85 gam.
Đáp án B
Cho các bước tiến hành thí nghiệm tráng bạc của glucozơ:
(1) Thêm 3 - 5 giọt glucozơ vào ống nghiệm.
(2) Nhỏ từ từ dung dịch NH3 cho đến khi kết tủa tan hết.
(3) Đun nóng nhẹ hỗn hợp ở 60 - 70°C trong vài phút.
(4) Cho 1 ml dung dịch AgNO3 1% vào ống nghiệm sạch.
Thứ tự tiến hành đúng là
Các bước tiến hành thí nghiệm theo thứ tự là:
(4) Cho 1 ml dung dịch AgNO3 1% vào ống nghiệm sạch.
(2) Nhỏ từ từ dung dịch NH3 cho đến khi kết tủa tan hết.
(1) Thêm 3 - 5 giọt glucozơ vào ống nghiệm.
(3) Đun nóng nhẹ hỗn hợp ở 60 - 70°C trong vài phút.
Đáp án A
Thuỷ phân hoàn toàn a mol triglixerit X trong dung dịch NaOH vừa đủ, thu được glixerol và m gam hỗn hợp muối. Đốt cháy hoàn toàn a mol X cần vừa đủ 7,75 mol O2 và thu được 5,5 mol CO2. Mặt khác, a mol X tác dụng tối đa với 0,2 mol Br2 trong dung dịch. Giá trị của m là
*Đốt a mol X:
Bảo toàn O → nH2O = 6nX + 2nO2 - 2nCO2 = 6a + 2.7,75 - 2.5,5 = 6a + 4,5 (mol)
Giả sử chất béo X có độ bất bão hòa toàn phân tử là k.
Ta có công thức:
\({n_X} = \frac{{{n_{C{O_2}}} - {n_{{H_2}O}}}}{{k - 1}} \to a = \frac{{5,5 - \left( {6{\rm{a}} + 4,5} \right)}}{{k - 1}}\)
→ ak + 5a = 1 (1)
*a mol X + Br2 thì:
X + (k - 3)Br2 → Sản phẩm cộng
→ nBr2 = (k - 3).nX → 0,2 = (k - 3).a
→ ak - 3a = 0,2 (2)
Như vậy ta có hệ pt:
\(\left\{ {\begin{array}{*{20}{l}}{ak + 5{\rm{a}} = 1}\\{ak - 3{\rm{a}} = 0,2}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{ak = 0,5}\\{a = 0,1}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{k = 5}\\{a = 1}\end{array}} \right.\)
BTKL phản ứng cháy → mX = mCO2 + mH2O - mO2 = 85,8 gam
BTKL phản ứng thủy phân → mmuối = mX + mNaOH - mC3H5(OH)3 = 85,8 + 0,3.40 - 0,1.92 = 88,6 gam.
Đáp án D
Rót từ từ dung dịch HCl vào dung dịch hỗn hợp X chứa a mol K2CO3 và 1,25a mol KHCO3 ta có đồ thị như hình bên. Khi số mol HCl là x thì dung dịch chứa 97,02 gam chất tan. Giá trị của a là
.png)
Rót từ từ H+ vào dung dịch hỗn hợp HCO3- + CO32- xảy ra 2 phản ứng theo thứ tự lần lượt:
H+ + CO32 → HCO3- (1)
H+ + HCO3- → CO2 ↑ + H2O (2)
- Khi nH+ = 2a mol, đã có khí CO2 thoát ra
⟹ (1) kết thúc, (2) đang xảy ra.
⟹ nCO2 = nH+(2) = nH+ - nH+(1) = nH+ - nCO32- = 2a - a = a (mol).
⟹ a = 0,25x hay x = 4a.
- Để phản ứng hết với HCO3- và CO32-, lượng HCl cần dùng bằng:
nHCl = nHCO3- + 2nCO32- = 1,25a + 2a = 3,25a (mol).
- Khi nHCl = x = 4a mol, dung dịch gồm:
\(\left\{ {\begin{array}{*{20}{l}}{KCl:3,25{a^{mol}}}\\{HC{l_{du}}:4a - 3,25a = 0,75{a^{mol}}\left( {BTNT.Cl} \right)}\end{array}} \right.\)
⟹ 74,5 . 3,25a + 36,5 . 0,75a = 97,02
⟹ a = 0,36 mol.
Đáp án D
Cho hỗn hợp E gồm X (C6H16O4N2 là muối của axit hai chức) và Y (C9H23O6N3, là muối của axit glutamic) tác dụng hoàn toàn với dung dịch KOH thu được 7,392 lít (đktc) hỗn hợp hai amin no (kế tiếp trong dãy đồng đẳng, có tỉ khối so với H2 là 107/6) và dung dịch T. Cô cạn T, thu được m gam hỗn hợp G gồm ba muối khan trong đó có 2 muối có cùng số nguyên tử cacbon trong phân tử. Giá trị của m là
MTB amin = 107/6 . 2 = 35,67 ⟹ 2 amin là CH3NH2 và C2H5NH2.
Đặt nCH3NH2 = a mol; nC2H5NH2 = b mol
⟹ \(\left\{ {\begin{array}{*{20}{l}}{a + b = 0,33}\\{31a + 45b = 0,33.\frac{{107}}{6}.2 = 11,77}\end{array}} \right.\)
⟹ a = 0,22; b = 0,11 (mol)
Kết hợp các dữ kiện:
- Công thức phân tử của X và Y
- Công thức của axit glutamic: HOOC-CH2-CH2-CH(NH2)-COOH
- Công thức 2 amin
- Hỗn hợp G gồm 3 muối trong đó có 2 muối có cùng số C
⟹ Công thức của X và Y lần lượt là:
X: (COONH3C2H5)2
Y: CH3NH3OOC-CH2-CH2-CH(NH3OOCCH3)-COOCH3NH3
⟹ nX = b/2 = 0,055 mol; nY = a/2 = 0,11 mol
- Khi hỗn hợp E + KOH:
(COONH3C2H5)2 + 2KOH → (COOK)2 + 2C2H5NH2 + 2H2O
CH3NH3OOC-CH2-CH2-CH(NH3OOCCH3)-COOCH3NH3 + 3KOH
→ KOOC-CH2-CH2-CH(NH2)-COOK + CH3COOK + 2CH3NH2 + 3H2O
Muối thu được gồm:
\(\left\{ {\begin{array}{*{20}{l}}{{{(COOK)}_2}:0,{{055}^{mol}}}\\{C{H_3}COOK:0,{{11}^{mol}}}\\{KOOCC{H_2}C{H_2}CH(N{H_2})COOK:0,{{11}^{mol}}}\end{array}} \right.\)
⟹ m = 44,44 gam.
Đáp án D
Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với cường độ dòng điện không đổi, điện cực trơ thấy thể tích khí thoát ra ở cả 2 điện cực (V lít, đktc) và thời gian điện phân (t giây) phụ thuộc nhau theo đồ thị hình bên.
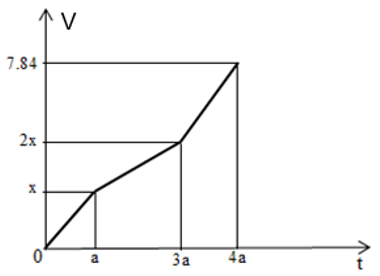
Nếu điện phân dung dịch đến thời gian 2a giây rồi dừng điện phân thì dung dịch sau điện phân có tổng số mol các chất tan là
- Chia đồ thị thành các đoạn như ở phần Phương pháp.
Ta thấy đoạn (2) độ dốc ít hơn so với đoạn (1)
Suy ra:
+ Giai đoạn 1: Khí Cl2 thoát ra từ anot (ở catot Cu2+ bị điện phân; ở anot Cl- bị điện phân)
+ Giai đoạn 2: Khí O2 thoát ra từ anot (ở catot Cu2+ bị điện phân; ở anot hết Cl-, nước bị điện phân)
+ Giai đoạn 3: Khí O2 thoát ra từ anot, khí H2 thoát ra từ catot (ở catot hết Cu2+, nước bị điện phân; ở anot nước bị điện phân).
- Khi kết thúc giai đoạn (1): t = a (s); ứng với sự trao đổi b (mol) electron
Ở anot: 2Cl- - 2e → Cl2 ↑
b → 0,5b (mol)
- Khi kết thúc giai đoạn (2): t = 3a (s); ứng với sự trao đổi 3b (mol) electron
Ở anot: 2Cl- - 2e → Cl2 ↑
b → 0,5b (mol)
H2O - 2e → 2H+ + ½ O2 ↑
2b → 0,5b (mol)
- Khi t = 4a (s), tổng số mol khí thu được là 0,35 mol; ứng với sự trao đổi 4b (mol) electron
Ở anot: 2Cl- - 2e → Cl2 ↑
b → 0,5b (mol)
H2O - 2e → 2H+ + ½ O2 ↑
3b → 0,75b (mol)
Ở catot: Cu2+ + 2e → Cu
3b → 1,5b (mol)
2H2O + 2e → 2OH- + H2 ↑
b → 0,5b (mol)
⟹ 0,5b + 0,75b + 0,5b = 0,35 ⟹ b = 0,2 mol
⟹ nCu(NO3)2 = 1,5.0,2 = 0,3 mol
nNaCl = b = 0,2 mol
- Khi t = 2a (s); ứng với sự trao đổi 2b = 0,4 mol electron
Ở anot: 2Cl- - 2e → Cl2 ↑
0,2 → 0,1 (mol)
H2O - 2e → 2H+ + ½ O2 ↑
0,2 → 0,05 (mol)
Ở catot: Cu2+ + 2e → Cu
0,4 → 0,2 (mol)
⟹ Dung dịch khi đó gồm
⟹ Tổng số mol các chất tan là 0,1 + 0,2 + 0,2 = 0,5 mol.
Đáp án B
Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO (trong đó oxi chiếm 25,39% về khối lượng hỗn hợp). Cho m gam hỗn hợp X tác dụng với 8,96 lít khí CO (ở đktc) sau một thời gian thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với hiđro là 19. Cho hỗn hợp Y tác dụng với dung dịch HNO3 loãng dư thu được dung dịch T và 7,168 lít khí NO (ở đktc, sản phẩm khử duy nhất). Cô cạn T thu được 3,456m gam muối khan. Giá trị của m gần nhất với giá trị nào sau đây?
nCO(bđ) = 0,4 mol; nNO = 0,32 mol
- Hỗn hợp khí Z gồm CO2: x (mol) và CO dư: y (mol)
⟹ \(\left\{ {\begin{array}{*{20}{l}}{x + y = {n_{CO}} = 0,4}\\{44x + 28y = {m_Z} = 0,4.19.2 = 15,2}\end{array}} \right.\)
⟹ x = 0,25; y = 0,15 (mol)
⟹ nO(bị CO lấy đi) = nCO2 = 0,25 (mol)
⟹ mY = mX - mO(bị CO lấy đi) = m - 0,25.16 = m - 4 (g)
⟹ nO(Y) = nO(X) - nO(bị CO lấy đi) = \(\frac{0,2593m}{16}-0,25\) (mol)
- Ta thấy H+ tham gia vào các bán phản ứng sau:
4H+ + NO3- + 3e → NO + 2H2O
2H+ + O2- → H2O
⟹ nHNO3 = nH+ = 4nNO + 2nO(Y)
= 4.0,32 + 2(\(\frac{0,2593m}{16}-0,25\)) = \(1,28+\frac{0,2593m}{8}-0,5\)
⟹ nH2O = nHNO3/2 = \(0,64+\frac{0,2593m}{16}-0,25\)
Bảo toàn khối lượng: mY + mHNO3 = mmuối + mNO + mH2O
⟹ \(m - 4 + 63(1,28 + \frac{{0,2593m}}{8} - 0,5) = 3,456m + 30.0,32 + 18(0,64 + \frac{{0,2593m}}{{16}} - 0,25)\)
⟹ m ≈ 38,43 gam.
Đáp án A
Đốt cháy hoàn toàn 0,6 mol hỗn hợp E chứa ancol X, este đơn chức Y và anđehit Z (X, Y, Z đều no, mạch hở và có cùng số nguyên tử hiđro) có tỉ lệ mol tương ứng 3 : 1 : 2 thu được 24,64 lít CO2 (đktc) và 21,6 gam nước. Mặt khác, cho 0,6 mol hỗn hợp E trên tác dụng với dung dịch AgNO3 trong NH3 đun nóng thu được m gam Ag. Giá trị m của là
- Khi đốt cháy hỗn hợp E:
nCO2 = 24,64/22,4 = 1,1 mol
nH2O = 21,6/18 = 1,2 mol
⟹ \(H=\frac{{{n}_{H}}}{{{n}_{hh}}}=\frac{2{{n}_{{{H}_{2}}O}}}{{{n}_{hh}}}=\frac{2.1,2}{0,6}=4\)
⟹ Ancol X phải là CH3OH
Tỉ lệ mol X, Y, Z là 3 : 1 : 2 ⟹ nX = 0,3 mol; nY = 0,1 mol; nZ = 0,2 mol.
- Gọi số nguyên tử cacbon trong Y là a; số nguyên tử cacbon trong Z là b (a, b ≥ 2)
⟹ 0,3 + 0,1a + 0,2b = 1,1
⟹ a + 2b = 8
⟹ a = 2, b = 3 thỏa mãn ⟹ Y là HCOOCH3, Z là OHC-CH2-CHO
- Y (HCOOCH3) phản ứng với Ag theo tỉ lệ 1 : 2, Z (HOC-CH2-CHO) phản ứng với Ag theo tỉ lệ 1 : 4
⟹ nAg = 2nY + 4nZ = 2.0,1 + 4.0,2 = 1 mol
⟹ mAg = 108 gam.
Đáp án C
Cho các phát biểu sau:
(a) Thủy phân tripanmitin và etyl axetat đều thu được ancol.
(b) Mỡ động vật và dầu thực vật đều chứa nhiều chất béo.
(c) Hiđro hóa triolein thu được tripanmitin.
(d) Thủy phân vinyl fomat thu được hai sản phẩm đều có phản ứng tráng bạc.
(e) Ứng với công thức đơn giản nhất là CH2O có 3 chất hữu cơ đơn chức, mạch hở.
Số phát biểu đúng là
- (a) đúng, thủy phân tripanmitin thu được glixerol, thủy phân etyl axetat thu được ancol etylic.
VD với MT kiềm:
(C15H31COO)3C3H5 + 3NaOH \(\xrightarrow[{}]{{{t}^{o}}}\) 3C15H31COONa + C3H5(OH)3
CH3COOC2H5 + NaOH \(\xrightarrow[{}]{{{t}^{o}}}\) CH3COONa + C2H5OH
- (b) đúng, mỡ động vật và dầu thực vật đều chứa nhiều chất béo.
- (c) sai, hiđro hóa hoàn toàn triolein thu được tristearin.
(C17H33COO)3C3H5 (triolein) + 3H2 \(\xrightarrow[{{t}^{o}}]{Ni}\) (C17H35COO)3C3H5 (tristearin).
- (d) đúng, thủy phân vinyl fomat thu được hai sản phẩm đều có phản ứng tráng bạc:
HCOOCH=CH2 .\(\xrightarrow[{{H}_{2}}S{{O}_{4}}dac,{{t}^{o}}]{{{H}_{2}}O}\). HCOOH + CH3CHO
HCOOCH=CH2 \(\xrightarrow[{{t}^{o}}]{NaOH}\) HCOONa + CH3CHO
- (e) đúng: ứng với công thức đơn giản nhất là CH2O có 3 chất hữu cơ đơn chức, mạch hở:
HCHO (anđehit đơn chức)
CH3COOH (axit đơn chức)
HCOOCH3 (este đơn chức)
Vậy có 4 phát biểu đúng (a, b, d, e).
Đáp án B
Đốt cháy hoàn toàn m gam hỗn hợp A gồm 3 este X, Y, Z (đều mạch hở và chỉ chứa chức este, Z chiếm phần trăm khối lượng lớn nhất trong A) thu được lượng CO2 lớn hơn H2O là 0,25 mol. Mặt khác, m gam A phản ứng vừa đủ với dung dịch NaOH thu được 22,2 gam 2 ancol hơn kém nhau 1 nguyên tử cacbon và hỗn hợp T gồm 2 muối. Đốt cháy hoàn toàn T cần vừa đủ 0,275 mol O2 thu được CO2, 0,35 mol Na2CO3 và 0,2 mol H2O. Phần trăm khối lượng của Z trong A là
- Khi đốt cháy hỗn hợp T gồm 2 muối:
nNa(T) = 2nNa2CO3 = 2.0,35 = 0,7 mol
Bảo toàn nguyên tố O: 2nCOONa + 2nO2 = 2nCO2 + 3nNa2CO3 + nH2O
⟹ nCO2 = (2.0,7 + 2.0,275 - 3.0,35 - 0,2) : 2 = 0,35 mol
Bảo toàn nguyên tố C: nC(T) = nCO2 + nNa2CO3 = 0,35 + 0,35 = 0,7 mol
⟹ nNa(T) = nC(T) ⟹ Các chất trong T có số nguyên tử C bằng số nguyên tử Na
⟹ T gồm 2 muối HCOONa và (COONa)2
nHCOONa = 2nH2O = 2.0,2 = 0,4 mol
n(COONa)2 = (0,7 - 0,4) : 2 = 0,15 mol
⟹ mT = 0,4.68 + 0,15.134 = 47,3 gam.
- Khi thủy phân hỗn hợp A:
nNaOH = nNa(T) = 0,7 mol ⟹ mNaOH = 40.0,7 = 28 gam.
Bảo toàn khối lượng: mA = mancol + mT - mNaOH = 22,2 + 47,3 - 28 = 41,5 gam.
- Khi đốt cháy hỗn hợp A:
Đặt nCO2 = x mol; nH2O = y mol
⟹ x - y = 0,25 mol (1)
nO(A) = 2nCOO = 2nNa(T) = 2.0,7 = 1,4 mol
Trong A gồm: x mol C; 2y mol H; 1,4 mol O
⟹ 12x + 2y + 1,4.16 = 41,5
⟹ 12x + 2y = 19,1 (2)
Từ (1)(2) ⟹ x = 1,4; y = 1,15
- Bảo toàn nguyên tố C:
nC(ancol) = nC(A) - nC(T) = 1,4 - 0,7 = 0,7 mol
nO(ancol) = nNaOH = 0,7 mol
nH(ancol) = nH(A) - nH(T) = 2.1,15 + 0,7 - 0,4 = 2,6 mol
⟹ nancol = nH2O - nCO2 = 2,6/2 - 0,7 = 0,6 mol (do số nguyên tử O trong ancol bằng số nguyên tử C nên 2 ancol đều là ancol no).
⟹ Số C TB = 0,7/0,6 = 1,17
Mặt khác, số nguyên tử O trong ancol bằng số nguyên tử C
⟹ Hai ancol đó là CH3OH: a mol và C2H4(OH)2: b mol
⟹ \(\left\{ {\begin{array}{*{20}{l}}{x + y = 0,6}\\{x + 2y = 0,7}\end{array}} \right.\) ⟹ x = 0,5; y = 0,1
- Ghép 2 muối ở hỗn hợp T và 2 ancol ta được:
\(\left\{ {\begin{array}{*{20}{l}}{HCOOC{H_3}:0,{2^{mol}}}\\{{{(HCOO)}_2}{C_2}{H_4}:0,{1^{mol}}}\\{{{(COOC{H_3})}_2}:0,{{15}^{mol}}}\end{array}} \right.\)
%mHCOOCH3 = 0,2.60/41,5 . 100% = 28,92%
%m(HCOO)2C2H4 = 0,1.118/41,5 . 100% = 28,43%
%m(COOCH3)2 = 100% - 28,92% - 28,43% = 42,65%
Mà Z chiếm % khối lượng lớn nhất ⟹ %mZ = 42,65%.
Đáp án B
Thực hiện các thí nghiệm sau:
(a) Cu vào dung dịch Fe2(SO4)3.
(b) Sục khí CO2 vào dung dịch Ca(OH)2.
(c) Sục hỗn hợp NO2 và O2 vào nước.
(d) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(e) Cho FeO vào dung dịch H2SO4 đặc, nóng.
(f) Hòa tan BaO vào nước.
Số thí nghiệm có xảy ra phản ứng oxi hóa - khử là
(a) Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
(b) CO2 + Ca(OH)2 → CaCO3 + H2O
(c) 4NO2 + O2 + 2H2O → 4HNO3
(d) 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
(e) 2FeO + 4H2SO4 đặc, nóng → Fe2(SO4)3 + SO2 + 4H2O
(f) BaO + H2O → Ba(OH)2
⟹ Có 4 thí nghiệm xảy ra phản ứng oxi hóa - khử: a, c, d, e.
Đáp án B
Cho các phát biểu sau:
(a) Dầu mỡ sau khi sử dụng, có thể tái chế thành nhiên liệu.
(b) Muối mononatri của axit glutamic được dùng làm bột ngọt (mì chính).
(c) Amilopectin, tơ tằm, lông cừu là polime thiên nhiên.
(d) Chất độn amiăng làm tăng tính chịu nhiệt của chất dẻo.
(e) Khi cho giấm ăn (hoặc chanh) vào sữa bò hoặc sữa đậu nành thì thấy có kết tủa xuất hiện.
(f) Thành phần chính của khi biogas là metan.
Số phát biểu đúng là
(a) đúng, dầu mỡ sau khi sử dụng, có thể tái chế thành nhiên liệu.
(b) đúng, muối mononatri của axit glutamic được dùng làm bột ngọt (mì chính).
(c) đúng, amilopectin, tơ tằm, lông cừu là polime thiên nhiên.
(d) đúng, chất độn amiăng làm tăng tính chịu nhiệt của chất dẻo.
(e) đúng, khi cho giấm ăn (hoặc chanh) vào sữa bò hoặc sữa đậu nành thì thấy có kết tủa xuất hiện (sự đông tụ protein).
(f) đúng, thành phần chính của khí biogas là metan.
Vậy cả 6 nhận định đều đúng.
Đáp án D
Trong tự nhiên, canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
CaSO4.2H2O được gọi là thạch cao sống.
Chọn A.
Kim loại X là một kim loại quý, dẫn điện tốt nhất trong số các kim loại và có nhiều ứng dụng: làm phim ảnh, gương cầu, ... Kim loại X là
Kim loại dẫn điện tốt nhất ⟹ Ag.
Chọn B.
Tơ nào sau đây thuộc loại tơ thiên nhiên?
Tơ thiên nhiên là tơ có nguồn gốc hoàn toàn từ tự nhiên ⟹ Tơ tằm là tơ thiên nhiên.
Chọn B.
Trong các ion sau đây, ion nào có tính oxi hóa mạnh nhất?
Tính oxi hóa của các ion: Al3+ < Cu2+ < Fe2+ < Ag+.
⟹ Ag+ có tính oxi hóa mạnh nhất.
Chọn B.
Trimetylamin có mùi tanh của cá. Bậc của trimetylamin là
Bậc amin bằng số nguyên tử của NH3 bị thay thế bởi gốc hiđrocacbon.
⟹ Trimetyl ((CH3)3N) là amin bậc 3.
Chọn D.
Thí nghiệm nào sau đây không xảy ra phản ứng?
Cu không tác dụng với dung dịch HCl.
PTHH:
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
Fe + Fe2(SO4)3 → 3FeSO4
Zn + CuSO4 → ZnSO4 + Cu
Chọn D.
Cho vài giọt phenolphtalein vào dung dịch NH3 thì dung dịch chuyển thành
Dung dịch NH3 có môi trường kiềm, làm dung dịch phenolphtalein chuyển sang màu hồng.
Chọn C.
Phản ứng nào sau đây có phương trình ion thu gọn là H+ + OH- → H2O?
A: H+ + OH- → H2O
B: Mg2+ + 2OH- → Mg(OH)2 ↓
C: OH- + HCO3- → CO32- + H2O
D: OH- + NH4+ → NH3 + H2O
Chọn A.
Chất nào sau đây thuộc loại đisaccarit?
Saccarozơ thuộc loại đisaccarit.
Chọn A.
Một loại mẫu nước cứng có chứa các ion Ca2+, Mg2+, HCO3-, Cl-, SO42-. Chất được dùng để làm mềm mẫu nước cứng trên là
Để làm mềm mẫu nước cứng trên ta có thể dùng Na3PO4 vì PO43- kết tủa hết Ca2+ và Mg2+:
Ca2+ + PO43- → Ca3(PO4)2 ↓
Mg2+ + PO43- → Mg3(PO4)2 ↓
Chọn C.
Polime nào sau đây được tổng hợp bằng phản ứng trùng hợp?
Poli(vinyl clorua) được điều chế bằng phản ứng trùng hợp vinyl clorua:
\(nC{{H}_{2}}=C{{H}_{2}}\left( vinylclorua \right)\xrightarrow{{{t}^{o}},xt,p}{{\left( -C{{H}_{2}}-C{{H}_{2}}- \right)}_{n}}\left( poli\left( vinylclorua \right) \right)\)
Kim loại nào sau đây là kim loại kiềm?
Li là kim loại kiềm.
Chọn C.
Cho hỗn hợp gồm Al, Zn vào dung dịch AgNO3. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X chỉ chứa một muối và phần không tan Y gồm hai kim loại. Hai kim loại trong Y và muối trong X là
- Kim loại có tính khử yếu sẽ được tạo ra trước nên thứ tự tạo kim loại: Ag → Zn → Al.
⟹ 2 kim loại là Ag và Zn dư.
- Muối chứa ion kim loại có tính oxi hóa yếu hơn sẽ tạo ra trước nên thứ tự tạo muối: Al3+ → Zn2+ → Ag+.
⟹ 1 muối là Al(NO3)3.
Hòa tan hoàn toàn 5,85 gam bột kim loại M vào dung dịch HCl, thu được 7,28 lít H2 (đktc). Kim loại M là
nH2 = 7,28/22,4 = 0,325 mol.
Giả sử kim loại M có hóa trị là n (n = 1; 2; 3).
2M + 2nHCl → 2MCln + nH2
\(\frac{0,65}{n}\) ← 0,325 (mol)
Ta có: mkim loại = \(\frac{{0,65}}{n}\).M = 5,85 → M = 9n.
⟹ n = 3; M = 27 thỏa mãn.
⟹ Kim loại là Al.
Chọn B.
α-amino axit X chứa một nhóm -NH2 và một nhóm -COOH. Cho 10,68 gam X tác dụng với axit HCl dư, thu được 15,06 gam muối khan. Công thức cấu tạo thu gọn của X là
Đặt công thức X là H2N-R-COOH.
H2N-R-COOH + HCl → ClH3N-R-COOH
BTKL: mHCl = mmuối - mX = 15,06 - 10,68 = 4,38 gam → nHCl = 4,38/36,5 = 0,12 mol.
Ta có: nX = nHCl = 0,12 mol ⟹ MX = 10,68/0,12 = 89.
Mà X là α-amino axit ⟹ X là CH3CH(NH2)COOH.
Chọn C.
Phát biểu nào sau đây sai?
- A sai, chỉ có các protein dạng cầu tan được trong nước; protein dạng sợi không tan trong nước.
- B đúng, do protein có chứa liên kết -CONH-, kém bền trong MT axit, bazo, enzim.
- C đúng.
- D đúng.
Chọn A.
Một este có công thức phân tử là C4H6O2, khi thủy phân trong môi trường axit thu được ancol. Công thức cấu tạo thu gọn của este đó là
Este RCOOR' thủy phân thu được ancol thì nhóm COO phải liên kết với nguyên tử C no của gốc R'.
⟹ CH2=CHCOOCH3 thủy phân thu được ancol.
PTHH:
A: HCOOCH=CHCH3 + H2O \(\xrightarrow{{{H}^{+}},{{t}^{o}}}\) HCOOH + CH3-CH2-CHO.
B: CH3COOCH=CH2 + H2O \(\xrightarrow{{{H}^{+}},{{t}^{o}}}\) CH3COOH + CH3CHO.
C: CH2=CHCOOCH3 + H2O \(\xrightarrow{{{H}^{+}},{{t}^{o}}}\) CH2=CHCOOH + CH3OH.
D: HCOOC(CH3)=CH2 + H2O \(\xrightarrow{{{H}^{+}},{{t}^{o}}}\) HCOOH + CH3-CO-CH3.
Chọn C.
Cho các chất sau: Al, Al2O3, Al(OH)3, AlCl3. Số chất tác dụng với dung dịch NaOH là
Tất cả các chất trên đều tác dụng được với dung dịch NaOH.
PTHH:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2;
Al2O3 + 2NaOH → 2NaAlO2 + H2O;
Al(OH)3 + NaOH → NaAlO2 + 2H2O;
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl.
Chọn A.
Geranyl axetat có mùi hoa hồng. Công thức của geranyl axetat là
Công thức của geranyl axetat là CH3COOC10H17.
Chọn B.
Bộ dụng cụ chiết được mô tả như hình bên:

Thí nghiệm trên được dùng để tách hai chất lỏng nào sau đây?
Sử dụng phiễu chiết để tách 2 chất lỏng không tan vào nhau.
⟹ Có thể sử dụng phễu chiết trên để tách etyl axetat và nước cất.
Chọn B.
Cho các phát biểu sau:
(a) Cho NH3 dư vào dung dịch AlCl3 thu được kết tủa keo trắng sau đó kết tủa tan dần.
(b) Nhỏ dung dịch Ba(HCO3)2 vào dung dịch KHSO4 thu được kết tủa trắng và có khí thoát ra.
(c) Mg cháy trong khí O2 ở nhiệt độ cao.
(d) Tất cả các kim loại kiềm thổ đều tác dụng với nước ở nhiệt độ thường.
Số phát biểu đúng là
(a) sai, vì Al(OH)3 không tan trong NH3 dư.
(b) đúng, PTHH: Ba(HCO3)2 + 2KHSO4 → BaSO4 ↓ + K2SO4 + 2CO2 + 2H2O.
(c) đúng, PTHH: 2Mg + O2 \(\xrightarrow{{{H}^{+}},{{t}^{o}}}\) 2MgO.
(d) sai, ví dụ như Be, Mg là kim loại kiềm thổ nhưng không phản ứng với nước ở nhiệt độ thường.
Vậy có 2 phát biểu đúng là (b) và (c).
Chọn C.
Cho các thí nghiệm sau:
(a) Cho Si tác dụng với dung dịch NaOH.
(b) Cho Cu vào dung dịch hỗn hợp Fe(NO3)3 và HCl.
(c) Sục khí CO2 vào dung dịch Na2SiO3.
(d) Cho bột Al vào dung dịch NaOH.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm tạo ra sản phẩm khí là
(a) Si + 2NaOH + H2O → Na2SiO3 + 2H2 ↑
(b) 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO ↑ + 4H2O
(c) CO2 + Na2SiO3 + H2O → Na2CO3 + H2SiO3 ↓
(d) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↑
Vậy có 3 thí nghiệm thu được khí là (a), (b), (d).
Chọn D.
Lên men 27 gam glucozơ thành ancol etylic với hiệu suất 50%, thu được V lít CO2. Giá trị của V là
nglucozo (ban đầu) = 27/180 = 0,15 mol → nglucozo (phản ứng) = 0,15.50% = 0,075 mol.
C6H12O6 → 2C2H5OH + 2CO2
0,075 → 0,15 (mol)
⟹ V = 0,15.22,4 = 3,36 lít.
Chọn D.
Tiến hành các thí nghiệm sau:
(a) Để gang trong không khí ẩm lâu ngày.
(b) Cho Fe tác dụng với dung dịch Fe(NO3)3.
(c) Cho Al tác dụng với dung dịch hỗn hợp gồm HCl và CuSO4.
(d) Cho Al và Fe tác dụng với khí Cl2 khô.
Trong các thí nghiệm trên, số thí nghiệm có hiện tượng ăn mòn điện hóa là
(a) Gang là hợp kim của Fe-C (ngoài ra còn 1 số chất khác) được để trong dung dịch điện li là không khí ẩm
⟹ có xảy ra ăn mòn điện hóa.
(b) Không có cặp điện cực khác nhau về bản chất
⟹ không xảy ra ăn mòn điện hóa.
(c) Có cặp điện cực Al-Cu (do phản ứng 2Al + 3Cu2+ → 2Al3+ + 3Cu) và được đặt trong dung dịch điện li
⟹ có xảy ra ăn mòn điện hóa.
(d) Không có dung dịch điện li
⟹ không xảy ra ăn mòn điện hóa.
Vậy có 2 thí nghiệm xảy ra ăn mòn điện hóa là (a) và (c).
Chọn A.
Cho m gam hỗn hợp Na, Ba vào nước thu được dung dịch X và 6,72 lít khí. Thể tích dung dịch hỗn hợp HNO3 1M và HCl 1M để trung hòa vừa đủ dung dịch X là
nH2 = 6,72/22,4 = 0,3 mol.
- Khi kim loại tác dụng với nước ta có: nOH- = 2nH2 = 0,6 mol.
- Trong phản ứng trung hòa: nH+ = nOH- = 0,6 mol.
Mà nH+ = nHNO3 + nHCl ⟹ V.1 + V.1 = 0,6 ⟹ V = 0,3 lít.
Chọn B.

