Đề thi giữa HK2 môn Hóa học 12 năm 2021 - Trường THPT Cẩm Phả
Đề thi giữa HK2 môn Hóa học 12 năm 2021 - Trường THPT Cẩm Phả
-
Hocon247
-
40 câu hỏi
-
60 phút
-
207 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Thạch cao sống là:
Thạch cao sống có CTPT là CaSO4.2H2O
Đáp án B
Cho các chất và ion sau: Fe; FeSO4; FeO; Fe3O4; Fe(NO3)3; FeCl2; Fe2+; Fe3+. Số lượng chất và ion có khả năng vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là
Các chất và ion có khả năng vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là các chất và ion có chứa nguyên tố có số oxi hóa trung gian.
Vậy các chất và ion có khả năng vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là: FeSO4; FeO; Fe3O4; Fe(NO3)3; FeCl2; Fe2+ (có 6 chất).
(Chú ý: Fe(NO3)3 thì Fe3+; N+5 nhận e còn O-2nhường e)
Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch Al2(SO4)3. Hiện tượng xảy ra là
Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch Al2(SO4)3 thì xảy ra các PTHH sau:
3Ba(OH)2 + Al2(SO4)3 → 3BaSO4 ↓ + 2Al(OH)3 ↓
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Hiện tượng xảy ra là xuất hiện kết tủa trắng gồm Al(OH)3 và BaSO4, sau đó tan một phần Al(OH)3 khi Ba(OH)2 dư.
Đáp án C
Có các kim loại Cu, Ag, Fe, Al, Au. Độ dẫn điện của chúng giảm dần theo thứ tự
Độ dẫn điện của chúng giảm dần theo thứ tự Ag, Cu, Au, Al, Fe.
Đáp án D
Cho 25 gam hỗn hợp bột gồm 5 oxit kim loại ZnO, FeO, Fe3O4, MgO, Fe2O3 tác dụng vừa đủ với 200 ml dung dịch HCl 2M. Kết thúc phản ứng, khối lượng muối có trong dung dịch X là
Ta có: nHCl = CM. Vdd = 0,2 . 2 = 0,4 (mol)
Sơ đồ: Oxit + HCl → Muối + H2O
Bảo toàn nguyên tố H → nH2O = ½ . nHCl = ½ . 0,4 = 0,2 (mol)
Bảo toàn khối lượng →
mmuối = moxit kim loại + mHCl - mH2O
= 25 + 0,4.36,5 - 0,2.18 = 36,0 gam
Đáp án B
Hiện tượng nào dưới đây được mô tả không đúng?
Khi thêm NaOH vào dung dịch FeCl3 màu vàng nâu thì ta thấy xuất hiện kết tủa nâu đỏ, không phải trắng xanh.
PTHH: 3NaOH + FeCl3 → Fe(OH)3↓ (nâu đỏ) + 3NaCl
Đáp án C
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng (dư), thu được dung dịch X. Trong các chất: NaOH, Cu, Fe(NO3)3, KMnO4, BaCl2, Cl2 và Al. Số chất có khả năng phản ứng được với dung dịch X là
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
→ Thành phần dung dịch X chứa Fe2+, Fe3+, SO42-, H+.
→ Có 7 chất là NaOH, Cu, Fe(NO3)3, KMnO4, BaCl2, Cl2 và Al tác dụng được với dung dịch X.
Các phương trình hóa học lần lượt xảy ra là:
OH- + H+ → H2O
Cu + 2Fe3+ → 2Fe2++ Cu2+
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
5Fe2+ + 8 H+ + MnO4- → 5Fe3+ + Mn2+ + 4 H2O
Ba2+ + SO42- → BaSO4
2Fe2+ + Cl2 → 2Fe3+ + 2Cl-
Al + 3H+ → Al3+ + 3/2 H2
Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
Quy đổi hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 về Fe: x mol và O: y mol.
⟹ 56x + 16y = 11,36 (1)
Ta có: nNO = 1,344 : 22,4 = 0,06 (mol)
Fe0 → Fe+3 + 3e O0 + 2e → O-2
x → 3x y → 2y
N+5 + 3e → N+2
0,18 ← 0,06
Bảo toàn electron: 3x = 2y + 0,18 (2)
Giải (1) và (2) ta được: x = 0,16 và y = 0,15
Bảo toàn nguyên tố Fe ta có: nFe(NO3)3 = nFe = 0,16 mol.
Vậy m = mFe(NO3)3 = 0,16.242 = 38,72 (g).
Đáp án B
Hợp chất được dùng để đúc tượng, bó bột khi gãy xương là
Thạch cao nung CaSO4.H2O được dùng để đúc tượng, bó bột khi gãy xương.
Đáp án A
Nhận xét nào sau đây sai?
B sai vì nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử kim loại: Mn+ + ne → M.
Hoà tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M thu được dung dịch X và 8,736 lít khí H2 (ở đktc). Cô cạn dung dịch X thu được lượng muối khan là
Ta có: nHCl = 0,5.1 = 0,5 mol; nH2SO4 = 0,5.0,28 = 0,14 mol
Suy ra nH+ = nHCl + 2.nH2SO4 = 0,78 (mol)
Ta có: nH2 = 8,736 : 22,4 = 0,39 (mol)
Nhận thấy nH2 = ½ . nH+ nên H+ phản ứng vừa đủ.
Vậy cô cạn dung dịch X thu được muối sunfat và muối clorua.
Khối lượng muối khan bằng:
mmuối = mMg2+ + mAl3+ + mCl- + mSO4
= 7,74 + 0,5.35,5 + 0,14.96 = 38,93
Nhiệt phân hoàn toàn 40g một loại quặng đôlômit có lẫn tạp chất trơ, sinh ra 8,96 lít CO2 (đktc). Thành phần % về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là
CaCO3.MgCO3 CaO + MgO + 2CO2
Ta có: nCaCO3.MgCO3 = ½ . nCO2 = ½ . 0,4 = 0,2 mol
Khối lượng CaCO3.MgCO3 trong loại quặng trên là 0,2.184 = 36,8 (g)
Thành phần % về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là:
\(\frac{{36,8}}{{40}} \times 100\% \) = 92%
Đáp án B
Kim loại nhôm tan được trong
Kim loại nhôm tan được trong dung dịch NaOH vì:
2 Al + 2 NaOH + 2 H2O → 2 NaAlO2 + 3 H2
Đáp án A
Hồng ngọc (Ruby), là một loại đá quý thuộc về loại khoáng chất corundum. Chỉ có những corundum màu đỏ mới được gọi là hồng ngọc, các loại corundum khác được gọi là Sa-phia. Thành phần chính của sa-phia, hồng ngọc là
- Hồng ngọc là tinh thể Al2O3 có một số ion Al3+ được thay thế bằng ion Cr3+.
- Sa-phia là tinh thể Al2O3 có lẫn tạp chất Fe2+, Fe3+, Ti4+.
Vậy thành phần chính của hồng ngọc và sa-phia là Al2O3.
Đáp án C
Tiến hành bốn thí nghiệm sau:
- Thí nghiệm 1: Nhúng thanh Fe vào dung dịch FeCl3;
- Thí nghiệm 2: Nhúng thanh Fe vào dung dịch CuSO4;
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3;
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl.
Số trường hợp xuất hiện ăn mòn điện hoá là
Thí nghiệm 1: Fe + 2FeCl3 → 3FeCl2
Ở đây chỉ có 1 điện cực là Fe nên không xảy ra ăn mòn điện hóa.
Thí nghiệm 2: Fe + CuSO4 → FeSO4 + Cu
Có 2 điện cực Fe và Cu tiếp xúc trực tiếp với nhau, nhúng trong cùng dung dịch chất điện li (muối sunfat).
→ Xảy ra ăn mòn điện hóa.
Thí nghiệm 3: Cu + 2FeCl3 → CuCl2 + 2FeCl2
Ở đây chỉ có 1 điện cực là Cu nên không xảy ra ăn mòn điện hóa.
Thí nghiệm 4: Có 2 điện cực Cu và Fe tiếp xúc trực tiếp với nhau, nhúng vào cốc đựng dung dịch HCl.
→ Xảy ra ăn mòn điện hóa.
Vậy có 2 thí nghiệm xuất hiện ăn mòn điện hóa.
Hòa tan hết 34,8 gam FexOy bằng dung dịch HNO3 loãng, thu được dung dịch A. Cho dung dịch NaOH dư vào dung dịch A. Kết tủa thu được đem nung ở nhiệt độ cao cho đến khối lượng không đổi. Dùng H2 dư để khử hết lượng oxit tạo thành sau khi nung, thu được 25,2 gam chất rắn. FexOy là
⟹ Chất rắn sau khi khử bằng H2 là Fe
⟹ mFe = 25,2 gam ⟹ nFe(oxit) = 25,2/56 = 0,45 mol
⟹ mO (oxit) = moxit - mFe = 34,8 - 25,2 = 9,6 (g) ⟹ nO(oxit) = 9,6/16 = 0,6 mol
Ta có: x : y = nFe : nO = 0,45 : 0,6 = 3 : 4
Vậy công thức oxit là Fe3O4.
Cho các chất: Al, AlCl3, Al2O3, Al(OH)3. Số chất có tính lưỡng tính là
Các chất có tính lưỡng tính là Al2O3, Al(OH)3 (có 2 chất).
Đáp án B
Cho các kim loại: Au, Al, Cu, Ag, Zn. Số kim loại tác dụng được với dung dịch H2SO4 loãng là
Các kim loại tác dụng được với dung dịch H2SO4 là các kim loại đứng trước H trong dãy hoạt động hóa học của kim loại.
Vậy các kim loại tác dụng được với dung dịch H2SO4 loãng là Al và Zn (có 2 kim loại).
Đáp án D
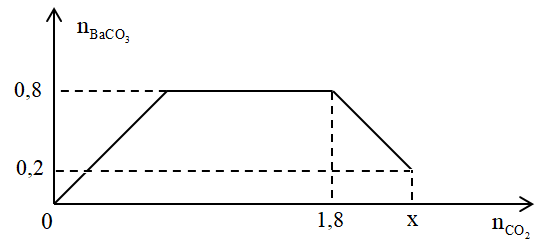
Cho từ từ x mol khí CO2 vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu diễn theo biểu đồ sau:
Tổng nồng độ phần trăm khối lượng của các chất tan trong dung dịch sau phản ứng là
Tại điểm A: nkết tủa = nBa2+ = nCO2 = 0,8 mol → nBa(OH)2 = 0,8 mol
Tại điểm B: kết tủa bắt đầu tan:
nCO3(2-) = nOH- - nCO2
⟹ 0,8 = nOH- - 1,8 → nOH- = 2,6 mol → nKOH = 2,6 - 0,8.2 = 1 mol
Tại điểm C: Kết tủa tan 1 phần:
nCO3(2-) = nOH- - nCO2
⟹ 0,2 = 2,6 - nCO2 → nCO2 = 2,4 mol
Dung dịch sau phản ứng có: 0,6 mol Ba2+; 1 mol K+; 2,2 mol HCO3- (áp dụng định luật bảo toàn điện tích)
⟹ mchất tan = 0,6.137 + 1.39 + 2,2.61 = 255,4 gam
Tương tự tìm mdd = mcác chất tham gia pứ - mkết tủa
= 2,4.44 + 500 - 0,2.197 = 566,2 (gam)
⟹ C%chất tan = \(\frac{255,4}{566,2}.100%\)= 45,11%
Đáp án A
Điện phân dung dịch CuSO4 nồng độ 0,5M với điện cực trơ trong thì thu được 1 gam Cu. Nếu dùng dòng điện một chiều có cường độ 1A, thì thời gian điện phân tối thiểu có giá trị gần nhất là
Áp dụng công thức Faraday để tính khối lượng chất thoát ra ở điện cực.
Khối lượng Cu thoát ra ở điện cực bằng: 50 phút 15 giây
Công thức oxit của kim loại kiềm có dạng
Kim loại kiềm là kim loại thuộc nhóm IA nên công thức oxit là R2O.
Đáp án A
Cho 200ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M; lượng kết tủa thu được là 15,6g. Giá trị lớn nhất của V là
Ta có: nAlCl3 = 0,2.1,5 = 0,3 mol; nAl(OH)3 = 15,6 : 78 = 0,2 mol
Ta thấy nAl(OH)3 < nAl3+, mà đề hỏi giá trị lớn nhất của V nên chứng tỏ Al(OH)3 đã bị tan 1 phần.
Khi đó nOH- = 4.nAl3+ - n↓ = 4. 0,3 - 0,2 = 1(mol)
Suy ra V = n : CM = 1 : 0,5 = 2,0 (lít)
Đáp án A
Hòa tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 vừa đủ, thu được dung dịch X (chỉ chứa 2 muối sunfat) và V lít (đktc) khí duy nhất NO. Giá trị của a và V lần lượt là
Ta có sơ đồ phản ứng: {FeS2, Cu2S} + HNO3 → Fe2(SO4)3 + CuSO4 + NO + H2O
Bảo toàn nguyên tố Fe ta có: nFe2(SO4)3 = 1/2.nFeS2 = 0,12/2 = 0,06 mol
Bảo toàn nguyên tố Cu ta có: nCuSO4 = 2.nCu2S = 2a mol
Bảo toàn nguyên tố S có nS(FeS2, Cu2S) = nS (trong 2 muối sunfat)
→ 2.0,12 + a = 3.0,06 + 2a → a = 0,06 mol
Quy đổi hỗn hợp ban đầu gồm 0,12 mol Fe; 0,12 mol Cu và 0,3 mol S
Bảo toàn electron ta có: 3.nFe + 2.nCu + 6.nS = 3.nNO ⟹ 3. 0,12 + 2. 0,12 + 6.0,3 = 3.nNO
Suy ra nNO = 0,8 mol và V = 0,8.22,4 = 17,92 lít.
Đáp án C
Hòa tan một lượng gồm hai kim loại kiềm vào nước thu được 100 ml dung dịch A và 112 ml H2 (đktc). Giá trị pH của dung dịch A là
Gọi công thức chung của hai kim loại kiềm là R
R + H2O → ROH + ½ H2
Ta có: nROH = 2.nH2 = 2.5.10-3 = 0,01 mol
⟹ [OH-] = nOH-/Vdd = 0,01 : 0,1 = 0,1 (M)
⟹ [H+] = 10-13‑M và pH = -log[H+] = 13
Đáp án A
Cho mạt sắt dư vào dung dịch X. Khi phản ứng kết thúc thấy khối lượng chất rắn giảm so với ban đầu. Dung dịch X có thể là
- Cho mạt sắt vào dung dịch CuSO4 thì xảy ra phương trình:
Fe + CuSO4 → FeSO4 + Cu
Ta thấy: mFe tan ra < mCu bám vào ⟹ Khối lượng chất rắn tăng
- Cho mạt sắt vào dung dịch FeCl3 thì xảy ra phương trình:
Fe + 2FeCl3 → 3FeCl2
Ta thấy chỉ có Fe tan ra ⟹ Khối lượng chất rắn giảm
- Cho mạt sắt vào dung dịch NiSO4 thì xảy ra phương trình:
Fe + NiSO4 → FeSO4 + Ni
Ta thấy: mFe tan ra < mNi bám vào ⟹ Khối lượng chất rắn tăng
- Cho mạt sắt vào dung dịch AgNO3 thì xảy ra phương trình:
Fe + 2AgNO3 → Fe(NO3)2+ 2Ag
Ta thấy: mFe tan ra < mAg bám vào ⟹ Khối lượng chất rắn tăng
Theo đề, sau khi phản ứng kết thúc thấy khối lượng chất rắn giảm so với ban đầu
→ Dung dịch X có thể là dung dịch FeCl3.
Đáp án B
Chọn phương trình hóa học sai.
Phương trình Cu + 2HCl → CuCl2 + H2 sai vì Cu là kim loại đứng sau H trong dãy hoạt động hóa học của kim loại nên không phản ứng được với HCl.
Đáp án B
Dãy các ion xếp theo chiều giảm dần tính oxi hoá là
Dãy các ion xếp theo chiều giảm dần tính oxi hoá là Ag+, Fe3+, Cu2+, Fe2+.
Đáp án B
Nước cứng gây ra nhiều tác hại trong đời sống cũng như trong sản xuất. Một mẩu nước cứng chứa các ion: Ca2+, Mg2+ , HCO3-, Cl-, SO42-. Chất được dùng để làm mềm mẫu nước cứng trên là
Chất được dùng để làm mềm mẩu nước cứng trên là Na2CO3 vì:
Mg2+ + CO32- → MgCO3↓
Ca2+ + CO32- → CaCO3↓
Lúc đó các ion Ca2+ và Mg2+ trong dung dịch bị loại bỏ nên nước cứng được làm mềm.
Đáp án A
Cho hỗn hợp gồm 8,4 gam sắt và 3,6 gam Mg tác dụng với dung dịch H2SO4 loãng dư, thể tích khí (ở đktc) thu được sau phản ứng là
Fe + H2SO4 → FeSO4 + H2
Mg + H2SO4 → MgSO4 + H2
Ta có: nH2 = nFe + nMg = 0,15 + 0,15 = 0,3 (mol)
Vậy VH2 = 0,3.22,4 = 6,72 lít
Đáp án C
Sắt (Fe) ở ô số 26 của bảng tuần hoàn các nguyên tố hóa học. Cấu hình electron của ion Fe2+ là
Cấu hình electron nguyên tử của 26Fe là [Ar]3d64s2.
Ta có: Fe → Fe2++ 2e
⟹ Cấu hình electron nguyên tử của ion Fe2+ là [Ar]3d6.
Đáp án C
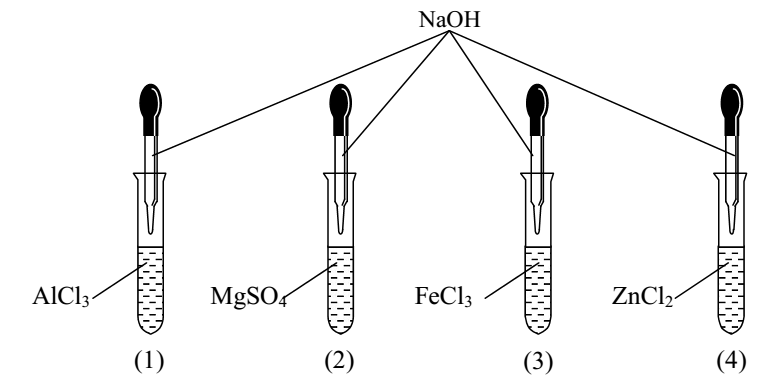
Tiến hành thí nghiệm như hình vẽ:
Nếu cho dung dịch NaOH đến dư thì số ống nghiệm thu được kết tủa khi phản ứng hoàn toàn là
Nếu cho dung dịch NaOH đến dư vào các dung dịch trên thì:
Ống 1:
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Ống 2:
MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4
Ống 3:
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
Ống 4:
ZnCl2 + 2NaOH → Zn(OH)2↓ + 2NaCl
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
Vậy cho dung dịch NaOH đến dư thì số ống nghiệm thu được kết tủa khi phản ứng hoàn toàn là ống (2) và ống (3) (có 2 ống nghiệm).
Đáp án A
Cho vị trí một số nguyên tố trong bảng tuần hoàn như sau:
Chọn C.
Kim loại kiềm thổ có tính khử yếu hơn kim loại kiềm cùng chu kỳ.
Kim loại kiềm thuộc nhóm IA, kim loại kiềm thổ thuộc nhóm IIA.
Khối lượng riêng của kim loại kiềm thổ đều nhỏ hơn Al (trừ Ba).
Các kim loại kiềm thổ đều mềm nhưng vẫn có độ cứng cao hơn kim loại kiềm.
Chất nào sau đây phản ứng được với tất cả các kim loại kiềm thổ ở nhiệt độ thường?
Chọn B
\(M + 2HCl \to MC{l_2} + {H_2}\)
Ở nhiệt độ thường:
\({O_2}\) không phản ứng với Be, phản ứng chậm với các kim loại còn lại.
\({H_2}O\) không phản ứng với Be, phản ứng chậm với Mg.
Ca, Ba, Sr phản ứng với \({H_2}O\) trong dung dịch \(CuS{O_4}.\)
Nước cứng không gây ra tác hại nào dưới đây?
Chọn A.
Nước cứng dễ tạo kết tủa khi đun nóng hoặc khi kết hợp với các chất khác làm gây cặn bám ở đáy dụng cụ đun nấu gây tốn nhiên liệu, bám vào thành ống dẫn, phản ứng với các chất trong thực phẩm
Cho X vào dung dịch \(HN{O_3}\) loãng thấy X tan một phần nhưng không sinh ra khí. X là kim loại nào trong số các kim loại sau đây?
Chọn C
X tan một phần \( \to \) X dư, X là Mg.
\(4Mg + 10HN{O_3} \to Mg{(N{O_3})_2}\)\(\, + N{H_4}N{O_3} + 3{H_2}O\)
Fe là kim loại hoạt động trung bình không sinh ra \(N{H_4}N{O_3}.\)
Hóa chất nào sau đây có thể dùng đồng thời làm mềm nước cứng tạm thời và nước cứng vĩnh cửu?
Chọn B
\(CO_3^{2 - } + C{a^{2 + }};M{g^{2 + }} \to CaC{O_3};MgC{O_3}\)
\(Ca{(OH)_2}\) chỉ làm mềm nước cứng tạm thời
Dùng HCl: chỉ có ion \(HCO_3^ - \) phản ứng \( \to \) không làm thay đổi tính cứng.
\(C{a_3}(P{O_4}){ _2}\) không tan, không phản ứng.
Phản ứng nào dùng để giải thích hiện tượng tạo thạch nhũ trong các hang động tự nhiên?
Chọn C.
Nước tự nhiên thường chứa \(Ca{(HC{O_3})_2}\) hay còn gọi là nước có tính cứng tạm thời, muốn phân hủy chậm trong tự nhiên sinh ra kết tủa \(CaC{O_3}\) là thành phần chính của thạch nhũ.
Có 4 dung dịch trong suốt, mỗi dung dịch chỉ chứa một loại cation và một loại anion. Các loại ion trong cả 4 dung dịch gồm: \(M{g^{2 + }};B{a^{2 + }};C{a^{2 + }};{K^ + };SO_4^{2 - };NO_3^{2 - };C{l^ - }\). Bốn dung dịch đó là
Chọn D.
Các ion không cùng tồn tại nếu kết hợp thành các chất không tan.
Các chất không tan: \(CaC{O_3},BaS{O_4},BaC{O_3}.\)
Hòa tan hoàn toàn 11,2 gam CaO vào nước được dung dịch A. Sục V lít \(C{O_2}\) (đktc) vào A được 2,5 gam kết tủa. Giá trị của V là
Chọn A.
Chia 2 trường hợp:
+ \(Ca{(OH)_2}\) dư: \({n_{C{O_2}}} = {n_{CaC{O_3}}} = 0,025\,mol\)
+ \(C{O_2}\) dư so với \(Ca{(OH)_2}\) hòa tan bớt kết tủa còn 0,025 mol.
\( \Rightarrow C{O_2}\) tạo 2 muối \(CaC{O_3}\) và \(Ca{(HC{O_3})_2}\)
\({n_{C{O_2}}} = {n_{CaC{O_3}}} + 2.{n_{Ca{{(HC{O_3})}_2}}} \)\(\,= 0,025 + 2.(0,2 - 0,025) = 0,375\,mol.\)
Cho 8,8 gam một hỗn hợp gồm 2 kim loại ở 2 chu kì liên tiếp thuộc nhóm IIA tác dụng với dung dịch HCl dư cho 6,72 lít khí hiro (đktc). Hai kim loại đó là
Chọn C.
\(\begin{array}{l}\overline M + 2HCl \to {H_2} + \overline M C{l_2}\\0,3\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,3\,\,\,\,mol\\\overline M = 29 \to Mg,Ca\end{array}\)