Đề thi giữa HK2 môn Hóa học 12 năm 2021 - Trường THPT Cửa Ông
Đề thi giữa HK2 môn Hóa học 12 năm 2021 - Trường THPT Cửa Ông
-
Hocon247
-
40 câu hỏi
-
60 phút
-
200 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Sắt có số oxi hóa +2 trong hợp chất nào sau đây?
Hợp chất có chứa nguyên tố Sắt có số OXH +2 là Fe(NO3)2
Đáp án A
Kim loại Mg chỉ bị ăn mòn hóa học khi tác dụng với dung dịch
Kim loại Mg chỉ bị ăn mòn hóa học khi tác dụng với dung dịch HCl
Đáp án A: Mg + AgNO3 → Mg(NO3)2 + 2Ag
=> Sinh ra kim loại Ag => Tạo ra 2 cực, đủ điều kiện sinh ra ăn mòn điện hóa
Đáp án B: 3Mg + 2FeCl3 → 3MgCl2 + 2Fe
=> Sinh ra kim loại Fe => Tạo ra 2 cực, đủ điều kiện sinh ra ăn mòn điện hóa
Đáp án D: Mg + Cu(NO3)2 → Mg(NO3)2 + Cu
=> Sinh ra kim loại Cu => Tạo ra 2 cực, đủ điều kiện sinh ra ăn mòn điện hóa
Đáp án C
Chất nào sau đây có tính lưỡng tính
Al2O3 là một oxit lưỡng tính
Al2O3 + 6HCl → 2AlCl3 + H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Đáp án C
Kim loại nào sau đây điều chế được bằng phương pháp điện phân dung dịch với điện cực trơ?
Kim loại có mức độ hoạt động trung bình, yếu thì có thể được điều chế bằng cách điện phân dung dịch có điện cực trơ (Kim loại đứng sau Al)
Na, Mg, Ba là những kim loại mạnh, chỉ được điều chế bằng phương pháp điện phân nóng chảy
Cu là kim loại được điều chế bằng phương pháp điện phân dung dịch điện cực trơ
Đáp án A
Để hòa tan hoàn toàn 1,53 gam Al2O3 cần dùng tối thiểu V ml dung dịch NaOH 1,2M. Gía trị của V là?
n Al2O3 = 1,53 : 102 = 0,015 (mol)
n NaOH = 2 * nAl2O3 = 0,03 (mol)
→ V NaOH = 0,03 : 1,2 = 0,025 lít = 25 ml
Đáp án D
Thành phần chính của quặng manhetit là?
Fe3O4: Manhetit
Fe2O3: Hemantit
FeS2: Pirit
FeCO3: Ciderit
Đáp án A
Al2O3 không phản ứng với dung dịch
Al2O3 là một oxit lưỡng tính nên có khả năng tác dụng với axit và bazo.
Al2O3 không tác dụng được với dung dịch muối Na2SO4
Đáp án D
Cho từ từ dung dịch NaOH vào dung dịch muối X, thấy xuất hiện kết tủa trắng, tan được trong NaOH dư. muối X là?
X là AlCl3. Ta có phương trình:
AlCl3 + NaOH → Al(OH)3 + 3NaCl
Al(OH)3 + NaOH → NaAlO2 +2H2O
Đáp án A
Công thức của canxi oxit là?
Canxi oxit có công thức là CaO
Đáp án B
Nước cứng là nước có chứa nhiều ion:
Nước cứng là nước có chứa nhiều ion Mg2+, Ca2+
Đáp án B
Chất có thể làm mềm nước cứng vĩnh cửu là?
Nước cứng vĩnh cửu là nước có chứa các ion: Mg2+, Ca2+, SO42-, Cl-
Để làm mềm nước cứng vĩnh cửu người ta thường dùng dung dịch Na2CO3
Mg2+ + CO32- → MgCO3
Ca2+ + CO32- → CaCO3
Đáp án C
Trong công nghiệp, kim loại nhôm được điều chế bằng phương pháp
Trong công nghiệp người ta thường điều chế kim loại Al bằng cách cho điện phân nóng chảy nhôm oxit
Đáp án D
Oxit nào sau đây tác dụng với HCl sinh ra hỗn hợp muối
Ta thấy:
8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O
Đáp án B
Cho dung dịch FeSO4 vào dung dịch chất X thu được kết tủa Fe(OH)2. Chất X là
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
Đáp án C
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử Na (Z = 11) là?
Z = 11: 1s22s22p63s1 => Cấu hình e lớp ngoài cùng của Na là 3s1
Đáp án D
Cho dung dịch Ba(OH)2 dư tác dụng hoàn toàn với dung dịch chất X, thu được một kết tủa duy nhất. Chất X là
Ba(OH)2 + Na2SO4 → BaSO4 +2NaOH
Đáp án C
Cho 0,46 gam kim loại Na tác dụng hoàn toàn với H2O, thu được V lít khí H2. Gía trị của V là?
Ta có: n Na = 0,46 : 23 = 0,02 (mol)
Ta có n H2 = ½ n Na = 0,01 (mol)
=> V H2 = 0,01 * 22,4 = 0,224 (lít)
Đáp án B
Cho 8,96 gam bột Fe tác dụng hoàn toàn với dung dịch CuSO4 dư thu được m gam kim loại Cu. Gía trị m là
nFe = 8,96 : 56 = 0,16 (mol)
Mặt khác lại có nCu = nFe = 0,16 (mol)
=> mCu = 0,16 * 64 = 10,24 (gam)
Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch?
Fe + 2FeCl3 → 3FeCl2
Fe + AgNO3 → Fe(NO3)2 + Ag
Fe + CuCl2 → FeCl2 + Fe
Đáp án B
BaCO3 tác dụng với dung dịch
BaCO3 tác dụng được với dung dịch axit H2SO4
BaCO3 + H2SO4 → BaSO4 + CO2 + H2O
Đáp án D
Kim loại nào sau đây tác dụng được với AgNO3 thu được kim loại Ag
AgNO3 + Zn → Zn(NO3)2 + 2Ag
Đáp án B
Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện
Kim loại có thể được điều chế bằng phương pháp nhiệt luyện là những kim loại thuộc dạng trung bình yếu (đứng sau Al)
Fe là kim loại có thể điều chế bằng phương pháp nhiệt luyện
Đáp án A
Ở nhiệt độ thường, kim loại kali phản ứng với nước tạo thành
Ta có phương trình phản ứng:
K + H2O → KOH + 1/2H2
Đáp án A
Trong sự ăn mòn kim loại xảy ra phản ứng
Ăn mòn kim loại là quá trình kim loại bị OXH bởi môi trường bên ngoài
Đáp án A
Cho kim loại Fe lần lượt tác dụng với các dung dịch: Al(NO3)3, Cu(NO3)2, AgNO3, Mg(NO3)2. Số trường hợp xảy ra phản ứng hóa học là?
Kim loại sắt có khả năng tác dụng được với: Cu(NO3)2, AgNO3,
Đáp án D
Cho sơ đồ chuyển hóa:
Fe → FeCl3 → Fe(OH)3 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là
Ta có phương trình phản ứng:
2Fe + 3Cl2 → 2FeCl3
FeCl3 + 3KOH → Fe(OH)3 + 3KCl
Đáp án D
Kim loại nào sau đây thuộc nhóm IA
Kim loại thuộc nhóm IA là Li
Đáp án D
Ở điều kiện thường, dung dịch Ba(HCO3)2 tác dụng được với dung dịch
Ba(HCO3)2 + 2HCl → BaCl2 + CO2 + H2O
Đáp án D
Kim loại Fe tác dụng với chất nào sau đây để tạo thành khí H2
Fe + HCl → FeCl2 + H2
Đáp án A
Cho m gam bột Fe tác dụng hoàn toàn với dung dịch HCl dư, thu được 3,36 lít khí H2. Gía trị của m là?
n H2 = 3,36 : 22,4 = 0,15 (mol)
n Fe = n H2 = 0,15 (mol)
=> m Fe = 0,15 * 56 = 4,2 (gam)
Đáp án A
Kim loại Fe tác dụng với dung dịch chất X loãng dư thu được muối Fe(III). Chất X là
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe + H2SO4 → FeSO4 + H2
Fe + HCl → FeCl2 + H2
Fe + CuSO4 → FeSO4 + Cu
Đáp án A
Phương trình hóa học nào sau đây là sai?
Fe + 2 HCl → FeCl2 + H2
→ Đáp án D sai
Hợp chất nào của canxi dùng để đúc tượng, bó bột khi gãy xương
Người ta thường dung thạch cao nung để đúc tượng, bó bột khi gãy xương
Đáp án C
Vào mùa lũ, để có nước sử dụng dân cử ở một số vùng thường sử dụng chất X có công thức K2SO4.Al2(SO4)3.24H2O để làm trong nước. Chất X được gọi là
Xem lại phần hợp chất của kim loại Nhôm có trong chương trình hóa học lớp 12
Hỗn hợp X gồm Al2O3, Ba, K (trong đó oxi chiếm 20% khối lượng của X). Hòa tan hoàn toàn m gam X vào nước dư thu được dung dịch Y và 0,176 mol khí H2. Cho từ từ đến dư dung dịch gồm 0,144 mol H2SO4 và 0,304 mol HCl vào Y thu được dung dịch Z (chỉ chứa các muối clorua và muối sunfat trung hòa) và 23,664 gam hỗn hợp kết tủa. Gía trị của m là
Đặt a, b, c là số mol Ba, K, Al2O3
Theo đề bài, khối lượng oxi trong X chiếm 20%
—> mO = 16.3c = 20%(137a + 39b + 102c) (1)
Cho X vào nước dư, thu được khí H2
Áp dụng định luật bảo toàn electron cho Ba và K
nH2 = a+0,5b = 0,176 (2)
Gọi số mol Al3+ còn lại trong dung dịch Z là x mol
=> Trong dung dịch Z chứa SO42-: (0,144 - a), Cl-: (0,304), K+ : (b), Al3+: x
Bảo toàn điện tích cho Z:
2(0,144 - a) + 0,304 =b+3x(3)
Sau khi cho Z vào Y thu được 23,664 gam kết tủa
=> Kết tủa gồm có BaSO4 và Al(OH)3
m kết tủa = 233a + 78(2c - x) = 23,664 (4)
Từ 1,2,3,4 —> a = 0,048; b = 0,256; c = 0,12; x =0,08
—>m = mBa + mK + mAl2O3 = 0,048 * 137 + 0,256 * 39 + 0,12 * 102 = 28,8 (gam)
Đáp án B
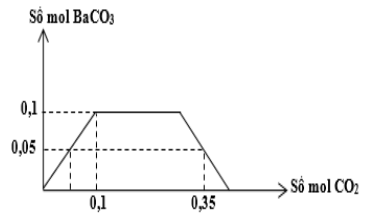
Cho m gam hỗn hợp K và Ba vào một lượng nước dư thu được dung dịch X và V lít khí H2 (đktc). Sục từ từ đến dư khí CO2 vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Khối lượng của K có trong m gam hỗn hợp là?
Ta nhận thấy, số mol BaCO3 lớn nhất là 0,1 mol => nBa = 0,1 (mol)
Xét tại vị trí số mol CO2 phản ứng là 0,35 mol
Khi đó nBaCO3 = 0,05 (mol)
Áp dụng định luật bảo toàn nguyên tố Ba
=> nBa(HCO3)2 = 0,1 – 0,05 = 0,05 (mol)
Áp dụng định luật bảo toàn nguyên tố C
=> n KHCO3 = 0,35 – 0,05 – 0,05 * 2 = 0,2 (mol)
=> n K = 0,2 mol => m K = 0,2 * 39 = 7,8 (gam)
Đáp án B
Hòa tan hết 31,36 gam hỗn hợp rắn X gồm Mg, Fe, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3 thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 46,54 gam kết tủa và 0,56 lít khí (đktc). Nếu cho Z tác dụng với dung dịch BaCl2 dư thì thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Fe3O4 trong X là
66.595 gam kết tủa là 0.715 mol BaSO4 — có nH2SO4 = nSO42- = 0.715 mol.
0.56 lít khí là 0,025 mol NH3
= Na+ trong Z = 0,715 x 2 - 1,285 = 0,145 mol — có 0,145 mol NaNO3.
Xét 46,54 gam kết tủa => nOH- = 1,285 - 0,025 = 1,26 (mol)
→ mKL có trong 46,54 gam kết tủa = 46,54 - 1,26 * 17 = 25,12 (gam)
Áp dụng định luật bảo toàn khối lượng ta có:
Gọi số mol khí H2 bay ra là x → nH2O sinh ra sau phản ứng = 0,715 -x
Ta có phương trình
31,36 + 0,145 * 85 + 0,715 * 98 + 0,025 * 18 = 25,12 + 0,145 *23 + 0,715 * 96 + 5,14 + (0,175 -x)
→ x = 0,05 (mol)
Y gồm CO2, N2, NO và 0.15 mol, nH2 = 0,05 mol nặng 5,14 gam.
Gọi nN2, n NO, nCO2 lần lượt là a, b, c
→ a + b + c = 0,15 (1)
Áp dụng định luật bảo toàn nguyên tố N
→ 2a + b = 0,145 - 0,025 = 0,12 (2)
Áp dụng định luật bảo toàn khối lượng:
28a + 30b + 44c = 5,14 - 0,05 * 2 (3)
Từ (1), (2), (3) → a =0,01, b=0,1, c=0,04 (mol)
→ nFeCO3 = nCO2 = 0,04 (mol)
→ mO trong X = 31,36 - mKL -mCO3 = 31,36 - 25,12 - 0,04 * 60 = 3,84 (gam)
→ nO = 3,84 : 16 = 0,24 (mol) => nFe3O4 = 0,06 (mol)
→ %mFe3O4 = 0,06 * 232 : 31,36 * 100% = 44,39%
Đáp án C
iến hành các thí nghiệm sau:
(a) Đốt cháy dây Mg trong không khí
(b) Sục khí Cl2 vào dung dịch FeSO4
(c) Cho Fe(NO3)2 vào dung dịch H2SO4 loãng
(d) Sục khí CO2 vào dung dịch Ca(OH)2
(e) Đun sôi dung dịch Ca(HCO3)2
Số thí nghiệm xảy ra phản ứng OXH – khử là
(a) Mg + O2 → MgO
(b) 6FeSO4 + 3Cl2 → 2FeCl3 + 2Fe2(SO4)3
(c) 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
(d) CO2 + Ca(OH)2 → CaCO3 + H2O
(e) Ca(HCO3)2 → CaCO3 + H2O
=> Có tất cả 3 phản ứng OXH khử
Đáp án D
Tiến hành các thí nghiệm sau:
(a) FeO tác dụng với dung dịch HNO3
(b) Fe(NO3)2 tác dụng với dung dịch HCl
(c) FeCO3 tác dụng với dung dịch H2SO4
(d) K tác dụng với dung dịch Fe2(SO4)3
(e) Ba tác dụng với dung dịch FeCl2
Sau khi phản ứng xảy ra hoàn toàn, số thí nghiệm tạo ra chất khí là?
Xét sản phẩm của từng phản ứng => Số phương trình thỏa mãn đề bài
(a) 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
(b) 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
(c) FeCO3 + H2SO4 → FeSO4 + CO2 + H2O
(d) K + H2O → KOH + H2
6KOH + Fe2(SO4)3 → 2Fe(OH)3 + 3K2SO4
(e) Ba + H2O → Ba(OH)2 + H2
Ba(OH)2 + FeCl2→ BaCl2 + Fe(OH)2
→ Số thí nghiệm sinh ra chất khí là: 5
Đáp án C
X gồm 12,48 gam Al và Fe2O3 tác dụng hoàn toàn với dung dịch HNO3 loãng dư, thu được 3,584 lít khí NO là sản phẩm khử duy nhất N+5. Phần trăm khối lượng Al trong X là?
nNO = 3,584 : 22,4 = 0,16 (mol)
Ta xét quá trình trao đổi e thì thấy
3 * nAl = 3 * nNO = 0,16 * 3 = 0,48 (mol)
=> nAl = 0,16 (mol)
% mAl = 0,16 * 27 : 12,48 * 100% = 34,62%
Đáp án C