Đề thi giữa HK2 môn Hóa học 12 năm 2021 - Trường THPT Nguyễn Du
Đề thi giữa HK2 môn Hóa học 12 năm 2021 - Trường THPT Nguyễn Du
-
Hocon247
-
40 câu hỏi
-
60 phút
-
201 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Hòa tan hoàn toàn m gam hỗn hợp X gồm FeO, Fe2O3 và Cu (trong đó FeO chiếm 1/5 tổng số mol hỗn hợp X) trong dung dịch HCl thu được dung dịch Z chỉ chứa 20,71 gam hỗn hợp 3 muối clorua. Mặt khác, hòa tan hoàn toàn m gam hỗn hợp X trên trong dung dịch chứa KNO3 và HCl, thu được dung dịch Y chỉ chứa các muối clorua và 0,448 lít khí NO (đktc, sản phẩm khử duy nhất của N+5). Trộn dung dịch Y với dung dịch Z thu được dung dịch T. Cho dung dịch AgNO3 tới dư vào T thu được 119,86 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với:
Bảo toàn nguyên tố N ta có: nKNO3 = nNO = 0,02 mol
Đặt a, b, c là số mol FeO, Fe2O3 và Cu
Ta có: nX = a + b + c = 5a (1)
-Thí nghiệm 1: Hòa tan hỗn hợp X trong dung dịch HCl:
Ta có: nH2O = nO (X) = a + 3b mol
Suy ra nCl- = nH+ = 2a + 6b mol
Khối lượng muối clorua thu được là:
mmuối clorua = mFe + mCu + mCl = 56. (a + 2b) + 64c + 35,5.(2a + 6b) = 20,71 (2)
-Thí nghiệm 2:
Ta có: nH+ = 4.nNO + 2.nO = 0,02.4 + 2(a + 3b)
→ nCl- = nH+ = 0,08 + 2a + 6b mol
Vậy nAgCl = nCl- tổng = 2a + 6b + 0,08 + 2a + 6b = 4a + 12b + 0,08 mol
Bảo toàn electron ta có: nAg = nFe + 2nCu - 3.nNO = (2a+4c) - 0,06 mol
119,86 gam kết tủa gồm AgCl và Ag
Suy ra 143,5. (4a + 12b + 0,08) + 108. (2a + 4c - 0,06) = 119,86 (3)
Giải hệ gồm (1), (2), (3) ta có: a = 0,02; b = 0,05 và c = 0,03
Suy ra m = 11,36 gam gần nhất với giá trị 11,4 gam
Đáp án A
Cho 19,55 gam hỗn hợp X gồm Zn, ZnO, Mg, MgCO3 vào dung dịch chứa 108,8 gam KHSO4 và 9,45 gam HNO3 đến phản ứng hoàn toàn thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 125,75 gam và 2,24 lít (đktc) hỗn hợp khí Z gồm hai khí, tỉ khối của Z so với H2 bằng 22. Cho dung dịch NaOH đến dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi, thu được 10 gam chất rắn khan. Phần trăm khối lượng của Zn có trong hỗn hợp X là
Ta có: nKHSO4 = 0,8 mol và nHNO3 = 0,15 mol
Ta có: MZ = 44 g/mol suy ra Z gồm 2 khí là CO2 và N2O
Bảo toàn khối lượng ta có: mX + mKHSO4 + mHNO3 = mY + mZ + mH2O
→ mH2O = 19,55 + 108,8 + 9,45 - 125,75 - 0,1.44 = 7,65 gam → nH2O = 0,425 mol
Bảo toàn nguyên tố H ta có: nKHSO4+ nHNO3 = 4.nNH4++ 2.nH2O
Suy ra nNH4+ = 0,025 mol
Cho dung dịch NaOH đến dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi, thu được 10 gam chất rắn khan. Chất rắn khan đó là MgO suy ra mMgO = 10 gam.
Ta có: nMgO = 0,25 mol
Vậy dung dịch Y gồm
Mg2+ (0,25 mol), K+ (0,8 mol), SO42- (0,8 mol), Zn2+ (a mol), NH4+ (0,025 mol) và NO3- (b mol)
Áp dụng định luật bảo toàn điện tích ta có:
0,25.2 + 0,8 + 2a + 0,025 = b + 0,8.2
Ta có: khối lượng muối trong dung dịch Y là:
mmuối = 0,25.24 + 0,8.39 + 0,8.96 + 65a + 18.0,025 + 62b = 127,75
Giải hệ trên ta có: a = 0,15 và b = 0,025
Bảo toàn nguyên tố N ta tìm được nN2O = 0,05 mol suy ra nCO2 = 0,05 mol
Ta có: nH+ = 0,8 + 0,15 = 10.nN2O + 10.nNH4+ + 2.nO suy ra nO = 0,1 mol
Ta có: nO = nZnO + nMgCO3 suy ra nZnO = 0,05 mol
Bảo toàn nguyên tố Zn suy ra nZn = 0,1 mol Suy ra %mZn = 33,25%
Đáp án B
Để tách lấy Ag ra khỏi hỗn hợp gồm Fe, Cu, Ag ta dùng lượng dư dung dịch
Chọn dung dịch chỉ có Fe và Cu phản ứng, Ag không thể phản ứng
→ Fe3+ là dung dịch cần tìm
Fe + 2Fe3+ → 3Fe2+
Cu + 2Fe3+ → 2Fe2+ + Cu2+
Đáp án D
Các kim loại bị thụ động hoá với HNO3 đặc, nguội hoặc H2SO4 đặc, nguội là
Al, Fe, Cr bị thụ động hoá với HNO3 đặc, nguội hoặc H2SO4 đặc, nguội
Đáp án A
Dãy gồm các hợp chất chỉ có tính oxi hoá là
Fe có số oxi hóa cao nhất là +3 => Các hợp chất sắt III chỉ có tính oxi hóa
Đáp án D
Ở một số địa phương sử dụng nước giếng khoan, khi mới bơm lên nước trong nhưng để lâu thì có mùi tanh và bị ngả màu vàng. Ion làm cho nước có màu vàng là
Khi mới bơm lên trong nước có sắt hóa trị 2, nhưng sau một thời gian tiếp xúc với không khí, sắt sẽ chuyển sang hóa trị 3, có màu vàng và nổi váng.
Đáp án D
Cấu hình electron lớp ngoài cùng của nguyên tử kim loại Mg (Z = 12) là
12Mg: 1s22s22p63s2
Đáp án B
Cho hỗn hợp gồm Mg và Al (tỉ lệ mol 1:1) tan vừa đủ trong dung dịch gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m gần nhất với giá trị nào sau đây?
Vì hỗn hợp khí thu được có dY/H2 = 12,2
=> Mkhí = 12,2.2 = 24,4
Có 1 khí hóa nâu ngoài không khí (NO có M = 30 > 24,4)
=> khí còn lại có M < 24,4
=> Chỉ có thể là H2 => NO3- hết trước H+.
Ta có: nNO + nH2 = 0,125 mol (1)
Và: mkhí = 30nNO + 2nH2 = 0,125.24,4 = 3,05g (2)
Từ (1,2) => nNO = 0,1 ; nH2 = 0,025 mol
Bảo toàn N: nNaNO3 + nKNO3 = nNO + nNH4 (nếu có)
=> nNH4 = 0,05 mol
Bảo toàn electron:
3nAl + 2nMg = 3nNO + 8nNH4 + 2nH2
= 3.0,1 + 8.0,05 + 0,025.2 = 0,75 mol
Và: nMg = nAl (Đề bài)
=> nMg = nAl = 0,15 mol
Vậy dung dịch X chứa:
0,15 mol Mg2+ ; 0,15 mol Al3+ ; 0,05 mol Na+ ; 0,1 mol K+ ; 0,05 mol NH4+ ; Cl-
Bảo toàn điện tích:
nCl = 2nMg + 3nAl + nNa + nK + nNH4 = 0,95 mol
=> m = åmion = 0,15.24 + 0,15.27 + 0,05.23 + 0,1.39 + 0,05.18 + 0,95.35,5 = 47,235g (Gần nhất với giá trị 47,3g)
Đáp án D
Cho 30 gam hỗn hợp X gồm Fe3O4 và Cu vào dung dịch HCl, sau phản ứng hoàn toàn thu được dung dịch Y chứa hai chất tan và còn lại 6,32 gam chất rắn. Cho dung dịch AgNO3 dư vào dung dịch Y thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây?
X + HCl: Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Mol x → x → 2x
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Mol x ¬ 2x → x → 2x
Vì sau phản ứng có 2 muối trong dung dịch
=> Chỉ có Cu2+ và Fe2+
Chất rắn sau phản ứng chỉ gồm Cu dư.
mchất phản ứng = 232.x + 64.x = mX – mCu dư = 30 – 6,32
=> x = 0,08 mol
=> Trong dung dịch có: 0,08mol CuCl2 và 0,24 mol FeCl2
Ag+ + Cl- → AgCl
Ag+ + Fe2+ → Fe3+ + Ag
=> Chất kết tủa gồm: 0,24 mol Ag và 0,64 mol AgCl
=> m = 117,76g (Gần nhất với giá trị 117,8g)
Đáp án D
Cho 5,4 gam Al tác dụng hết với khí Cl2 (dư), thu được m gam muối. Giá trị của m là
Al + 1,5Cl2 → AlCl3
Bảo toàn nguyên tố: nAl = nAlCl3 = 5,4 : 27 = 0,2 mol
=> mAlCl3 = 0,2.133,5 = 26,7g
Đáp án A
Để phân biệt dung dịch CaCl2 với dung dịch NaCl, người ta dùng dung dịch
Chỉ có CaCl2 có phản ứng với muối cacbonat tạo kết tủa trắng:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Đáp án C
Dãy các kim loại được xếp theo chiều tính khử tăng dần là
Tính khử: Fe < Al < Mg
Đáp án B
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol NaOH và b mol NaAlO2, kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
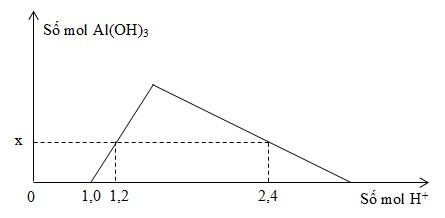
Tổng giá trị (a + b) là
Thứ tự phản ứng: H+ + OH- → H2O
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
- Tại: nH+ = 1,0 mol => bắt đầu có kết tủa
=> Phản ứng trung hòa hoàn toàn => nOH = 1 mol = a
- Tại nH+ = 1,2 mol => chưa có hiện tượng hòa tan kết tủa
=> nAl(OH)3 = nH+ pứ = 1,2 – 1 = 0,2 mol
- Tại nH+ = 2,4 mol => có hiện tượng hòa tan 1 phần kết tủa
=> nAl(OH)3 = 1/3.(4nAlO2 – nH+ pứ)
=> 0,2 = 1/3.[4b – (2,4 – 1,0)] => b = 0,5 mol
=> (a + b) = 1,5 mol
Dung dịch NaOH không tác dụng với
NaOH không phản ứng được với FeO.
Các PTHH xảy ra:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
NaHCO3 + NaOH → Na2CO3 + H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Đáp án C
Chất không có tính lưỡng tính là
AlCl3 không thể nhận proton (H+) nên không phải là chât lưỡng tính
Đáp án D
Sắt tây là sắt tráng thiếc. Nếu lớp thiếc bị xước sâu tới lớp sắt thì
Ở đây xuất hiện pin điện Fe-Sn trong đó Fe có tính khử mạnh hơn nên bị ăn mòn trước Sn
Đáp án B
Chất có thể làm mềm nước cứng toàn phần là
Chất thỏa mãn là Na2CO3
PT ion:
Ca2+ + CO32- → CaCO3↓
Mg2+ + CO32- → MgCO3↓
Đáp án A
Hai dung dịch đều phản ứng được với kim loại Fe là
Fe + CuSO4 → FeSO4 + Cu
Fe + 2HCl → FeCl2 + H2
Đáp án D
Cho H2 dư qua m gam hỗn hợp chất rắn X gồm Fe, CuO, Fe3O4 nung nóng, phản ứng kết thúc thấy khối lượng chất rắn giảm 0,48 gam. Nếu hòa tan hoàn toàn m gam X vào V(ml) dung dịch HNO3 0,5M vừa đủ thì thu được tối đa 1,344 lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là
- Quy hỗn hợp X về: Fe, Cu, O
- Khi X + H2 nghĩa là: [O] + H2 → H2O
=> mrắn giảm = mO pứ = 0,48g => nO(X) = ,48: 16 = 0,03 mol
-Khi X + HNO3: nNO = 1,344: 22,4 = 0,06 mol
=> Ta có: nHNO3 = 4nNO + 2nO = 4.0,06 + 2.0,03 = 0,3 mol
=> VHNO3 = 0,3: 0,5 = 0,6 lít = 600 ml
Đáp án C
Cho dãy các ion kim loại: K+, Ag+, Fe2+, Cu2+. Ion kim loại có tính oxi hóa mạnh nhất trong dãy là
Tính oxi hóa: Ag+ > Cu2+ > Fe2+ > K+
Đáp án C
Ở nhiệt độ cao, khí H2 khử được oxit nào sau đây?
Chất khử trung bình (C, CO, H2) chỉ khử được những oxit của những kim loại đứng sau Al trong dãy điện hóa.
Do đó H2 chỉ có thể khử được oxit CuO
Đáp án C
Nung hỗn hợp gồm Mg(OH)2 và Fe(OH)2 ngoài không khí cho đến khi khối lượng không đổi thu được chất rắn có thành phần là
Mg(OH)2 \(\xrightarrow{{{t}^{0}}}\)MgO + H2O
2Fe(OH)2 + ½ O2 \(\xrightarrow{{{t}^{0}}}\) Fe2O3 + 2H2O
Vậy chất rắn gồm: MgO, Fe2O3
Đáp án B
Phát biểu nào sau đây sai?
A sai vì quặng hematit có thành phần chính là là Fe2O3.
B, C, D là các phát biểu đúng
Đáp án A
Hòa tan hoàn toàn 18 gam hỗn hợp gồm Al và Al2O3 trong dung dịch NaOH giải phóng 3,36 lít khí H2 (đktc). Khối lượng của Al2O3 trong hỗn hợp là
nH2 = 3,36: 22,4 = 0,15 mol
Al + NaOH + H2O → NaAlO2 + 1,5H2
Mol 0,1 ¬ 0,15
=> mAl2O3 = 18 – mAl =18 – 0,1.27 = 15,3g
Đáp án C
Phản ứng của cặp chất nào sau đây sản phẩm có muối Fe(II)?
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
FeCO3, FeO + HNO3 → Fe3+ + sản phẩm khử
Đáp án A
Chất X là một bazơ mạnh, được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất clorua vôi (CaOCl2), vật liệu xây dựng. Ngoài ra chất X còn dùng để xử lí chất thải. Công thức của X là
Ca(OH)2 là một bazơ mạnh, được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất clorua vôi (CaOCl2), vật liệu xây dựng. Ngoài ra chất X còn dùng để xử lí chất thải.
Đáp án A
Để bảo vệ ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) bằng phương pháp điện hóa, người ta gắn vào mặt ngoài của ống thép những khối kim loại bằng
(*) Ứng dụng pin điện:
Khi gắn tấm kẽm lên ống thép tức là ta tạo ra 1 pin điện Zn-Fe trong đó Zn là cực âm là Zn và cực dương là Fe(trong thép). Trong pin điện hóa, cực dương diễn ra quá trình oxi hóa
=> Zn sẽ bị oxi hóa trước Fe
Đáp án C
Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là
AlCl3 + 3NaOH → Al(OH)3↓(keo trắng) + 3NaCl
Al(OH)3 + NaOH → NaAlO2(tan) + 2H2O
Như vậy hiện tượng xảy ra là: Ban đầu có kết tủa keo trắng, sau đó kết tủa tan dần.
Đáp án C
Trong công nghiệp người ta thường điều chế kim loại K bằng cách?
Trong công nghiệp, để điều chế các kim loại kiềm người ta tiến hành điện phân nóng chảy muối clorua của chúng.
KCl \(\xrightarrow{{{t}^{0}}}\)K + ½ Cl2
Đáp án D
Phát biểu nào sau đây sai?
- Nước cứng là nước chứa nhiều Ca2+ ; Mg2+.
(Nếu chứa ít 2 cation trên thì vẫn chưa gọi là nước cứng)
Đáp án C
Điện phân dung dịch chứa hỗn hợp gồm HCl, FeCl3, CuCl2. Thứ tự điện phân ở catot là
Tính oxi hóa: Fe3+ > Cu2+ > H+ > Fe2+ > H2O
(Fe2+ do Fe3+ bị điện phân sinh ra)
=> Thứ tự điện phân ở catot là:
Fe3+ > Cu2+ > H+ > Fe2+ > H2O
Đáp án A
Cho một lá kẽm có khối lượng 8,5 gam vào dung dịch FeSO4, sau phản ứng lấy lá kẽm ra làm khô, cân được 7,6 gam (giả thiết toàn bộ sắt sinh ra bám hết vào lá kẽm). Lượng Zn đã phản ứng là
Zn + Fe2+ → Zn2+ + Fe
Mol x → x
=> Dmgiảm = mZn pứ - mFe tạo ra
=> 8,5 – 7,6 = 65x – 56x => x = 0,1 mol
=> mZn pứ = 65.0,1 = 6,5g
Đáp án C
Sục khí nào sau đây vào dung dịch Ca(OH)2 dư thấy xuất hiện kết tủa màu trắng?
Sục khí CO2 vào dd Ca(OH)2 dư thu được kết tủa trắng CaCO3:
Ca(OH)2 + CO2 → CaCO3↓(trắng) + H2O
Đáp án A
Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước?
Kim loại kiềm, kiềm thổ (trừ Be, Mg) có thể phản ứng với nước ở điều kiện thường.
Vậy Be không phản ứng được với nước ở điều kiện thường.
Đáp án B
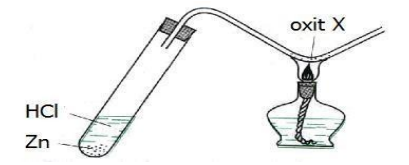
Cho hình vẽ mô tả thí nghiệm điều chế kim loại bằng phương pháp nhiệt luyện:
Trong hình vẽ trên, oxit X là
- Khi cho Zn phản ứng với HCl sinh ra H2: Zn + 2HCl → ZnCl2 + H2
- H2 sinh ra chỉ khử được CuO
Đáp án A
Chất nào sau đây không tạo kết tủa khi tác dụng với dung dịch Ca(HCO3)2?
PTHH:
- Phương án A:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Phương án B:
Ca(HCO3)2 + NaOH → CaCO3↓ + NaHCO3 + H2O
hoặc Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O
- Phương án C:
Ca(HCO3)2 + Na2CO3 → CaCO3 + 2NaHCO3
- Phương án D:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Vậy phản ứng câu A không tạo ra kết tủa.
Đáp án A
Khử hoàn toàn hỗn hợp gồm m gam FeO, Fe2O3, Fe3O4 bằng CO dư ở nhiệt độ cao, sau phản ứng thu được 33,6 gam chất rắn và 17,92 lít CO2 (đktc). Giá trị của m là
Ta có: Oxit + CO → Chất rắn + CO2
nCO2 = 17,92 : 22,4 = 0,8 mol
Bảo toàn nguyên tố: nCO = nCO2 = 0,8 mol
Bảo toàn khối lượng: m + mCO = mrắn + mCO2
=> m = 33,6 + 0,8.44 – 0,8.28 = 46,4g
Đáp án B
Cho dãy các kim loại kiềm: Na, Li, Cs, Rb . Kim loại có nhiệt độ nóng chảy thấp nhất là
Cs là kim loại có nhiệt độ nóng chảy thấp nhất trong các kim loại kiềm.
Đáp án B
Hòa tan hoàn toàn 8,4 gam Fe bằng dung dịch HNO3 loãng dư, thu được V lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là
Fe → Fe3+ + 3e
N5+ + 3e → N2+
=>Bảo toàn e: nFe = nNO = 8,4 : 56 = 0,15 mol
=> VNO = 0,15.22,4 = 3,36 lít
Đáp án D