Đề thi giữa HK2 môn Hóa học 10 năm 2021 - Trường THPT Yên Mô A
-
Hocon247
-
40 câu hỏi
-
60 phút
-
64 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Khí oxi điều chế được thường có lẫn hơi nước. Để thu được khí oxi khô, người ta thường dẫn hỗn hợp khí thu được đi quã
Để thu được khí O2 khô, ta cần cho đi qua chất có khả năng hút được nước và không tác dụng được với khí oxi
Đáp án B
Trường nào không xảy ra phản ứng hóa học?
Phản ứng A không xảy ra do FeS có khả năng tan trong HCl
Đáp án A
Phát biểu nào sau đây là đúng khi nói về phản ứng
\({H_2}S + C{l_2} + {H_2}O \to {H_2}S{O_4} + HCl\)
Phản ứng trên có:
S có số OXH tăng từ -2 (H2S) lên +6 (H2SO4)
Cl2 có số OXH giảm từ 0 (Cl2) xuống -1 (HCl)
→ H2S là chất khử, Cl2 là chất OXH
Đáp án D
Cách sơ cứu hiệu quả nhất để hạn chế tối đa tác hại của tai nạn do uống nhầm axit sunfuric (H2SO4) là:
Để sơ cứu do bỏng axit, ta cần rửa bằng nước sạch nhiều lần để làm loãng nồng độ của axit, loại bỏ các phương tiện dính axit trên vùng bị bỏng (quần áo, trang sức,...).
Đáp án C
Trong phòng thí nghiệm, oxi thường được điều chế bằng cách nào dưới đây?
Trong phòng thí nghiệm oxi thường được điều chế bằng cách nhiệt phân KClO3 có xúc tác MnO2
Ta có phương trình:
KClO3 → KCl + 3/2 O2
Đáp án A
Đốt cháy hoàn toàn m gam hỗn hợp các kim loại gồm Al, Fe, Mg cần vừa đủ 6,72 lít khí O2 ( đktc). Sau phản ứng thu được 24,6 gam hỗn hợp chất rắn. Giá trị của m là
\(m\left( g \right)\left\{ \matrix{ Al \hfill \cr Fe + 0,3\left( {mol} \right){O_2} \to 24,6\left( g \right) \hfill \cr Mg \hfill \cr} \right.\)
Áp dụng định luật bảo toàn khối lượng ta có:
\(\eqalign{ & m + {m_{{O_2}}} = {m_r} \to m = {m_r} - {m_{{O_2}}} \cr & \to m = 24,6 - 0,3.32 = 15\left( {gam} \right) \cr} \)
Đáp án A.
Đốt cháy hoàn toàn m gam FeS2 thu được 2,24 lít khí SO2 ( đktc). Giá trị của m là
FeS2 tác dụng với oxi theo phản ứng:
\(\eqalign{ & {\rm{ 4Fe}}{{\rm{S}}_2} + 11{O_2} \to 2F{e_2}{O_3} + 8S{O_2} \cr & {n_{S{O_2}}} = \dfrac{2,24}{22,4} = 0,1\left( {mol} \right) \cr & {n_{Fe}} = \dfrac{1}{2}{n_{S{O_2}}} = \dfrac{1}{2}.0,1 = 0,05\left( {mol} \right) \cr & {m_{Fe{S_2}}} = 0,05.120 = 6gam \cr} \)
Đáp án C.
Một hợp chất có thành phần theo khối lượng là 1,12%H; 35,96%S; còn lại là oxi. Hợp chất này có công thức phân tử là
Gọi công thức của hợp chất đã cho là: HxSyOz.
Ta có: \(\eqalign{ x:y:z &= {{\% H} \over 1}:{{\% S} \over {32}}:{{\% O} \over {16}} \cr&= {{1,12} \over 1}:{{35,96} \over {32}}:{{62,92} \over {16}} \cr & = 1,12:1,12:3,94 \cr&= 1:1:3,5 \cr&= 2:2:7 \cr} \)
Công thức của hợp chất là H2S2O7.
Đáp án C.
Trái cây được bảo quản lâu hơn trong môi trường vô trùng. Trên thực tế, người ta dùng nước ozon để bảo quản trái cây. Ứng dụng trên dựa trên tính chất nào sau đây?
Người ta dùng ozon để bảo quản trái cây là dựa vào tính OXH mạnh của ozon
Đáp án D
Cho 3,68 gam hỗn hợp CaCO3 và CaO phản ứng vừa đủ với 0,5 lít dung dịch HCl thu được 0,448 lít khí (đktc). Thành phần phần trăm khối lượng của CaCO3 và CaO trong hỗn hợp ban đầu là
Phương trình hóa học
\(\eqalign{ & CaO + HCl \to CaC{l_2} + {H_2}O{\rm{ }}\left( 1 \right) \cr & CaC{O_3} + HCl \to CaC{l_2} + C{O_2} + {H_2}O{\rm{ }}\left( 2 \right) \cr & {n_{C{O_2}}} = {V \over {22,4}} = {{0,448} \over {22,4}} = 0,02\left( {mol} \right) \cr} \)
Theo phương trình (2) :
\({n_{CaC{O_3}}} = {n_{C{O_2}}} = 0,02\left( {mol} \right) \to \% {m_{CaC{O_3}}} = \frac{{0,02.100}}{{3,68}}.100 = 54,3\% {\text{ }} \to \% {m_{CaO}} = 100 - 54,3\% = 45,7\% \)
Đáp án B.
Hòa tan hoàn toàn 11,9 gam hỗn hợp X gồm Al và Zn bằng dung dịch HCl dư thu được 8,96 lít khí H2 (đktc). Thể tích O2 (đktc) cần dùng để phản ứng hoàn toàn hỗn hợp X trên là
\({n_{{H_2}}} = \dfrac{V}{{22,4}} = \dfrac{{8.96}}{{22,4}} = 0,4\left( {mol} \right)\)
Gọi x, y lần lượt là số mol của Al và Zn trong hỗn hợp
\( \Rightarrow 27x + 65y = 11,9\left( 1 \right)\)
Khi phản ứng với HCl
\(\eqalign{ & Al \to A{l^{3 + }} + 3e\;\;\;\;\;\;{\rm{ 2}}{{\rm{H}}^ + } + 2e \to {H_2} \cr & x{\rm{ }} \to\;\;\;\;\;\;\;\;\;\;\;\;\; {\rm{ 3x }}\;\;\;\;\;\;0,8 \leftarrow \;\;\;\;\;\;\;\;\;\;{\rm{0,4}} \cr & {\rm{Zn}} \to Z{n^{2 + }} + 2e \cr & y{\rm{ }} \to \;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{ 2y}} \cr} \)
Áp dụng định luật bảo toàn electron ta có: \(3x + 2y = 0,8\) (2)
Từ (1) và (2) ta có: \(x = 0,2; y = 0,1\)
Khi tác dụng với oxi:
\(\eqalign{ & Al \to A{l^{3 + }} + 3e{\rm{ }}\;\;\;\;\;\;\;{{\rm{O}}_2} + 4e \to 2{O^{2 - }} \cr & 0,2 \to \;\;\;\;\;\;\;\;{\rm{ 0,6 }} \;\;\;\;\;\;\;0,2\leftarrow {\rm{0,8mol}} \cr & {\rm{Zn}} \to {\rm{Z}}{{\rm{n}}^{2 + }} + 2e \cr & 0,1 \to \;\;\;\;\;\;\;\;\;{\rm{ 0,2mol}} \cr & {{\rm{V}}_{C{l_2}}} = 0,2.22,4 = 4,48\left( {lit} \right) \cr} \)
Đáp án D.
Kem đánh răng chứa một lượng muối flo ( như CaF2, SnF2 ) có tác dụng bảo vệ lớp men răng vì nó thay thế một phần hợp chất có trong men răng là Ca5(PO4)3OH thành Ca5(PO4)3F. Điều này có ý nghĩa quan trọng trong bảo vệ răng vì lớp Ca5(PO4)3F
Điều này có ý nghĩa quan trọng trong bảo vệ răng vì lớp Ca5(PO4)3F không bị môi trường axit trong miệng sau khi ăn bào mòn.
Đáp án B
Dãy nguyên tố nào dưới đây được xếp theo chiều tính oxi hóa tăng dần?
Tính OXH thể hiện ở khả năng nhận e. Chất nhận e càng dễ thì tính OXH càng mạnh.
Trong một nhóm, xét theo chiều từ trên xuống dưới, tính OXH của các nguyên tố giảm dần.
Đáp án A
Đổ dung dịch AgNO3 vào dung dịch muối nào sau đây sẽ có kết tủa màu trắng xuất hiện?
Đổ AgNO3 vào NaCl sẽ thấy có kết tủa trắng xuất hiện.
Đáp án B
Nguyên nhân chủ yếu làm cho đơn chất clo có tính oxi hóa mạng hơn đơn chất nitơ ở điều kiện thường là
Nguyên nhân chủ yếu làm cho đơn chất clo có tính oxi hóa mạng hơn đơn chất nitơ ở điều kiện thường là liên kết trong phân tử clo là liên kết đơn còn trong phân tử nitơ là liên kết ba.
Đáp án D
“Chảo chống dính” cõ lẽ là vật dụng không thể thiếu với các bà nội trợ hiện nay bởi những công dụng tuyệt vời của nó như: chiên thức ăn không bị dính, tiết kiệm dầu ăn... Sở dĩ, “không dính” vì mặt trong của chảo được tráng một lớp polime nhiệt dẻo có tính bền cao với các dung môi và hóa chất. Hợp chất được nhắc tới trong trường hợp này là
Đó là poli tetraflo etilen (-CF2-CF2-) được tôn vinh là “vua chất dẻo” thường gọi là “teflon”. Pholitetra floetilen chỉ chứa
Nguyên tố C và F nên liên kết với nhau rất bền chắc. Khi cho teflon vào axit vô cơ hay axit H2SO4 đậm đặc, nước cường thủy (hỗn hợp HCl và HNO3 đặc), vào dung dịch kiềm đun sôi thì teflon không hề biến chất. Dùng teflon tráng lên đáy chảo khi đun với nước sôi không hề xảy xa bất kì tác dụng nào. Các loại dầu ăn, muối, dấm,... cũng không xảy ra hiện tượng gì. Cho dù không cho dầu mỡ mà trực tiếp rán cá, trứng trong chảo thì không xảy ra hiện tượng gì.
Đáp án A.
Đặc điểm chung của các nguyên tố nhóm halogen là
Đặc điểm chung của các nguyên tố nhóm halogen là chất có tính OXH mạnh
Đáp án B
Đầu thế kỷ 19 người ta sản xuất natri sunfat bằng cách cho axit sunfuric đặc tác dụng với muối ăn. Khi đó, xung quanh các nhà máy sản xuất bằng cách này, dụng cụ của thợ thủ công rất nhanh hỏng và cây cối bị chết rất nhiều. Người ta đã cố gắng cho thoát khí thải thoát ra bằng những ống khói cao tới 300m nhưng tác hại của khí thải vẫn tiếp diễn, đặc biệt là khí hậu ẩm. Hãy chó biết khí thải đó có chứa thành phần chủ yêu nào trong các chất sau?
NaCl(r) + H2SO4(đ) → Na2SO4 + 2HCl(k)
Đáp án A
Cho 500 ml dung dịch NaOH 1,8 M phản ứng với 500 ml dung dịch FeCl3 0,8 M thu được dung dịch A và chất rắn B. khối lượng chất rắn B là
nNaOH = CM.V = 1.8.0,5 = 0,9 (mol)
n FeCl3 = CM.V = 0,8.0,5 = 0,4 (mol)
Phương trình 3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Chất rắn thu được sau phản ứng là Fe(OH)3.
Khối lượng chất rắn sau phản ứng là: MB = 0,3.107 = 32,1 (gam)
Đáp án C.
Clorua vôi là hỗn hợp của
Clorua vôi là hỗn hợp của CaOCl2 và H2O
Đáp án C
Clo vừa là chất oxi hóa vừa là chất khử trong phản ứng của clo với
Cl2 + 2NaOH → NaCl + NaClO + H2O
Đáp án D
Cho dung dịch sắt (II) clorua, thêm dư vào dung dịch axit clohiđric, sau đó thêm 0,5 gam một hỗn hợp muối kali clorua và kali nitrat. Sau phản ứng thu được 100 ml một chất khí (ở đktc và đã được làm khô). Thành phần phần trăm về khối lượng của hỗn hợp muối kali chorua và kali nitrat lần lượt là
Gọi a là số mol khí sinh ra sau phản ứng:
6FeCl2 + 8HCl + 2KNO3 → 6FeCl3 + 2KCl + 2NO + 4H2O
nKNO3 = nNO = 0,1 : 22,4 mol → %KNO3 = 90,18%
%KCl = 9,82%
Brom bị lẫn tạp chất là clo, để thu được brom cần làm cách nào sau đây?
Cl2 + NaBr → NaCl + Br2
Đáp án C
Cho hình vẽ sau
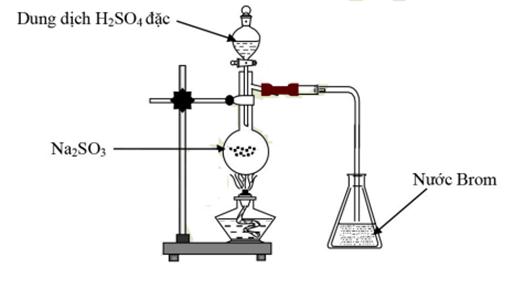
Hiện tượng xảy ra trong bình eclen chứa brom là
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
SO2 + Br2 + H2O → H2SO4 + HBr
Sau phản ứng, dung dịch Brom bị mất màu.
Đáp án B
Có các hóa chất: K2Cr2O7, HCl, KMnO4, MnO2, NaCl, HClO, H2SO4, KClO3. Những chất được sử dụng để điều chế Cl2 trong phòng thí nghiệm là
Trong phòng thí nghiệm, người ta thường dùng một số hợp chất có tính OXH mạnh (KClO3, MnO2,…) tác dụng với dung dịch HCl đặc
Đáp án B
Để điều chế được 16,25 gam FeCl3 cần cho sắt phản ứng vừa đủ với V lít khi clo (đktc). Giá trị của V là
\(\eqalign{ & {n_{FeC{l_3}}} = 0,1\left( {mol} \right) \cr & {\rm{ 2Fe + 3C}}{{\rm{l}}_2}\buildrel {t^\circ } \over \longrightarrow 2FeC{l_3} \cr} \)
Theo phương trình:
\(\eqalign{ & {n_{C{l_2}}} = 0,15\left( {mol} \right) \cr & \Rightarrow {V_{C{l_2}}} = 0,15.22,4 = 3,35\left( {lit} \right) \cr} \)
Đáp án D.
Cho biết số hiệu nguyên tử của các nguyên tố N, F và P lần lượt là 7, 9 và 15. Dựa vào cấu hình electron và qui luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn, hãy so sánh tính phi kim của P và F.
Từ số hiệu nguyên tử của nguyên tố N là 7 (nguyên tử của nguyên tố N có 7 electron).
Cấu hình electron của N là: 1s22s22p3 (N thuộc chu kì 2, nhóm VA).
Tương tự F: 1s22s22p5 \( \to \) F thuộc chu kì 2, nhóm VIIA
P: 1s22s22p63s23p3 \( \to \) P thuộc chu kì 3, nhóm Va
Như vậy N, F thuộc cùng 1 chu kì. Trong cùng 1 chu kì, theo chiều tăng của điện tích hạt nhân thì tính phi kim tăng. Như vậy F có tính phi kim mạnh hơn N (1).
Mặt khác N và P lại cùng thuộc nhóm VA. Trong cùng nhóm., theo chiều từ trên xuống dưới, tính phi kim giảm, do đó N có tính phi kim mạnh hơn P (2).
Từ (1) và (2) suy ra F có tính phi kim mạnh hơn P.
Đáp án A.
Nhận định nào sau đây sai khi nói về flo?
A. Là phi kim hoạt động mạnh nhất. (đúng)
B. Có nhiều đồng vị trong tự nhiên. (sai)
C. Là chất oxi hóa rất mạnh. (đúng)
D. Có độ âm điện lớn nhất. (đúng)
Đáp án B
Cho hỗn hợp gồm các chất sau: Mg(HCO3), CuO, Ag, CuS, KOH, KNO3, Fe(OH)3, Na2SO4. Số chất có khả năng tác dụng với dung dịch HCl là
Các chất có khả năng tác dụng với dung dịch HCl là: Mg(HCO3)2, CuO, KOH, Fe(OH)3.
Đáp án B.
Để nhận biết 5 lọ mất nhãn đựng các dung dịch: HCl, KOH, Ca(NO3)2, BaCl2, thuốc thử cần dùng là
Khi dùng quỳ tím:
+ HCl: quỳ tím chuyển thành màu đỏ
+ KOH: quỳ tím chuyển thành màu xanh
+ Ca(NO3)2, BaCl2: quỳ tím không đổi mau
Để phân biệt Ca(NO3)2, BaCl2 nên sử dụng dung dịch AgNO3
+ có kết tủa tráng: BaCl2
+ không hiện tượng: Ca(NO3)2
\(BaC{l_2} + 2AgN{O_3} \to Ba{\left( {N{O_3}} \right)_2} \)\(\,+ 2AgCl \downarrow \)
Đáp án A.
Hòa tan 31,6 gam KMnO4 bằng một lượng vừa đủ 400 ml dung dịch HCl thu được V lít khí (đktc). Giá trị của V là
\({n_{KMn{O_4}}} = {m \over M} = {{31,6} \over {158}} = 0,2\left( {mol} \right)\)
Phương trình hóa học
\(\eqalign{ & {\rm{ 2KMn}}{{\rm{O}}_4} + 16HCl \to 2KCl + 2MnC{l_2} + 5C{l_2} + 8{H_2}O \cr & {\rm{ 0,2 }} \to\;\;\;\;\;\;\;\; {\rm{ 1,6 }} \to\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; {\rm{ 0,5 }}\left( {mol} \right) \cr & \to {V_{C{l_2}}} = 0,5.22,4 = 11,2\left( {lit} \right) \cr} \)
Đáp án B.
Cho các phát biểu sau
(a) Đổ dung dịch AgNO3 vào dung dịch NaF thu được kết tủa.
(b) Người ta dùng lọ thủy tinh để đựng dung dịch axit flohiđric.
(c) Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
(d) Tính oxi hóa của các đơn chất halogen giảm theo thứ tự I2, Br2, Cl2, F2.
Phát biểu đúng là
(a) Đổ dung dịch AgNO3 vào dung dịch NaF thu được kết tủa: Sai, vì AgF không kết tủa.
(b) Người ta dùng lọ thủy tinh để đựng dung dịch axit flohiđric: Sai, vì axit flohiđric có khr năng ăn mòn thủy tinh.
(c) Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit: Đúng
(d) Tính oxi hóa của các đơn chất halogen giảm theo thứ tự I2, Br2, Cl2, F2: Sai, vì tính oxi hóa giảm theo thứ tự: F2, Cl2, Br2, I2.
Phát biểu đúng là (c)
Đáp án B.
Phát biểu nào sau đây không đúng?
A. Axit flohiđric là một axit yếu, có tính chất ăn mòn thủy tinh. (đúng)
B. Các nguyên tố halogen đều tồn tại ở trạng thái khí và phân tử chỉ gồm một nguyên tử. (sai)
C. Flo oxi hóa nước dễ dàng ở nhiệt độ thường nên không thể tạo được nước flo. (đúng)
D. Khi điện phân dung dịch muối ăn không có màng ngăn, ta thu được nước Javen. (đúng)
Đáp án B
Trong phản ứng hóa học sau:
\(S{O_2} + B{r_2} + 2{H_2}O \to {H_2}S{O_4} + 2HBr\).
Vai trò của Br2 là
Sau phản ứng số OXH của Br2 giảm từ 0 xuống -1 (HBr)
→ Br2 là chất OXH (chất bị khử)
Đáp án B
Để điều chế clo trong công nghiệp ta phải dùng điện phân có màng ngăn cách hai điện cực để
Để điều chế clo trong công nghiệp ta phải dùng điện phân có màng ngăn cách hai điện cực để khí Cl2 không tiếp xúc với dung dịch NaOH.
Đáp án A
Cho phương trình:
\({K_2}C{r_2}{O_7} + HCl \to CrC{l_3} + C{l_2} + KCl + {H_2}O\)
Tỉ lệ giữa số phân tử HCl đóng vai trò là chất khử và số phân tử HCl tham gia phản ứng
\(\eqalign{ & {K_2}\mathop {C{r_2}}\limits^{ + 6} {O_7} + H\mathop {Cl}\limits^{ - 1} \to KCl + {\mathop {Cr}\limits^{ + 3} _2}C{l_3} + {H_2}O + \mathop {C{l_2}}\limits^0 \cr & {\rm{ C}}{{\rm{r}}_2} + 6e \to 2C{r^{ + 3}}| \times 1 \cr & {\rm{ 2C}}{{\rm{l}}^ - } \to C{l_2} + 2e{\rm{ |}} \times {\rm{3}} \cr & \to {{\rm{K}}_2}C{r_2}{O_7} + 14HCl \to 2KCl + 2CrC{l_3} + 7{H_2}O + 3C{l_2} \cr} \)
Vậy trong 14 phân tử HCl tham gia phản ứng chỉ có 6 HCl đóng vai trò là chất khử còn 8 phân tử HCl tham gia tạo muối.
Vậy tỉ lệ giữa số phân tử HCl đóng vai trò là chất khử và số phân tử HCl tham gia phản ứng là: 6:14 = 3:7
Đáp án D.
Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY ( X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
Do trong số các muối halogenua có muối AgF tan, do vậy để giải một cách chính xác bài toán này ta cần xét hai trường hợp:
TH1: Hỗn hợp gồm NaF và NaCl
\({n_{AgCl}} = {m \over M} = {{8,61} \over {143,5}} = 0,06\left( {mol} \right)\)
Phương trình hóa học
\(NaF + AgN{O_3} \to \) không xảy ra
\(\eqalign{ & NaCl + AgN{O_3} \to AgCl \downarrow + NaN{O_3} \cr & 0,06{\rm{ }} \leftarrow \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{ 0,06}} \cr & \to {m_{NaCl}} = 0,06.58,5 = 3,51g \cr & \to {m_{NaF}} = 6,03 - 3,51 = 2\% ,52g \cr & \% NaCl = {{2,52} \over {6,03}}.100 = 41,8\% \cr} \)
TH2: Hỗn hợp 2 muối không chứa NaF
Gọi công thức chung của NaX và NaY là \(\overline M .\)
\(\eqalign{ & Na\overline M + AgN{O_3} \to Ag\overline M \downarrow + NaN{O_3} \cr & 6,03g\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{ 8,61g}} \cr & {\rm{23 + }}{{\rm{M}}_{\overline M }}\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{ 108 + }}{{\rm{M}}_{\overline M }} \cr} \)
Bằng phương pháp tăng giảm khối lượng ta có:
\(\eqalign{ & {n_{Na\overline M }} = {{8,61 - 6,03} \over {108 - 23}} = 0,03\left( {mol} \right) \cr & \to {M_{Na\overline M }} = {{6,03} \over {0,03}} = 201\cr& \to {\overline M _{X,Y}} = 178 \cr} \)
\( \to \) không có cặp nguyên tố halogen nào thỏa mãn.
Đáp án B.
Dung dịch HCl không tác dụng với cặp chất nào sau đây?
HCl không tác dụng được với kim loại đứng sau H, dung dịch muối mà sản phẩm không tạo chất kết tủa hay khí bay lên.
Đáp án B
Hòa tan khí clo vào dung dịch KOH đặc nóng, dư thu được dung dịch chứa các chất thuộc dãy nào sau đây?
6KOH (đ,n) + 3Cl2 → 5KCl + KClO3 + 3H2O
Đáp án D
Nguyên tử của nguyên tố (A) có tổng số hạt p,n,e là 34 trong đó tỉ lệ giữa số hạt mang điện và hạt không mang điện là 11: 6. Số hạt không mang điện trong nguyên tử A là
Tống số hạt p, n, e là 34
→ 2p + n = 34 (I)
Tỉ lệ giữa số hạt mang điện và hạt không mang điện là 11 : 6
→ 2p : n = 11 : 6 (II)
Từ (I) và (II) → p = 11; n = 12
Đáp án B

