Đề thi giữa HK2 môn Hóa học 10 năm 2021 - Trường THPT Ngô Quyền
-
Hocon247
-
40 câu hỏi
-
60 phút
-
66 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Dãy đơn chất nào sau đây được sắp xếp đúng theo thứ tự tính oxi hoá giảm dần?
Tính oxi hoá giảm dần theo thứ tự F2 , Cl2, Br2, I2. Chọn đáp án B.
Phản ứng hóa học nào sau đây không xảy ra?
KCl + Br2 → không xảy ra do tính oxi hóa Br2 < Cl2.
Chọn đáp án B.
Cho 8,7 gam MnO2 tác dụng với lượng dư dung dịch HCl đặc, đun nóng. Thể tích khí thoát ra (ở đktc) là
MnO2 + 4HCl → MnCl2 + Cl2 + H2O.
Số mol Cl2 = số mol MnO2 = 0,1 mol. Vậy V = 2,24 lít.
Chọn đáp án C.
Dãy chất nào dưới đây tác dụng được với dd HCl?
Dãy chất tác dụng được với dd HCl là AgNO3, NaOH, CuO.
Chọn đáp án C.
Cho 25,6 gam hỗn hợp G gồm: FeCO3 và Mg vào một lượng vừa đủ m gam ddHCl 10%. Sau phản ứng thu được dung dịch A và 6,72 lít khí B ở đktc. % khối lượng của FeCO3 và Mg lần lượt là
FeCO3 + 2HCl → FeCl2 + CO2 + H2O.
a a (mol)
Mg + 2HCl → MgCl2 + H2.
b b (mol)
giải hệ có x = 0,2; y = 0,1
→ % khối lượng FeCO3 và Mg lần lượt là 90, 625% và 9,375%. Chọn đáp án A.
Các nguyên tố halogen có cấu hình electron lớp ngoài cùng là
Các nguyên tố halogen có cấu hình electron lớp ngoài cùng là ns2np5.
Chọn đáp án A.
Kết tủa hoàn toàn m gam NaCl bởi dung dịch AgNO3 dư thấy thu được 2,87 gam kết tủa. Giá trị của m là
NaCl + AgNO3 → NaNO3 + AgCl
0,02 ← 0,02 (mol)
m = 0,02.58,5 = 1,17 gam.
Chọn đáp án D.
Thành phần của nước Gia – ven là
Thành phần của nước Gia – ven là NaCl, NaClO, H2O.
Chọn đáp án A.
Dung dịch axit nào sau đây không thể chứa trong bình thủy tinh?
Axit HF có tính chất đặc biệt là ăn mòn thủy tinh nên không thể đựng trong bình thủy tinh.
Chọn đáp án C.
Đổ dung dịch chứa 1 mol NaOH vào dung dịch chứa 1 mol HCl. Nhúng giấy quỳ tím vào dung dịch thu được thì quỳ tím chuyển sang màu nào?
NaOH + HCl → NaCl + H2O
1 1 (mol)
Sau phản ứng dung dịch thu được chỉ chứa NaCl, vậy dung dịch sau phản ứng không làm quỳ tím đổi màu.
Chọn đáp án C.
Nguyên tố nào sau đây không thuộc nhóm halogen?
P thuộc nhóm VA không thuộc nhóm halogen (VIIA).
Chọn đáp án C.
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là
CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O (1)
1 1 (mol)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (2)
1 2,5 (mol)
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O (3)
1 3 (mol)
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (4)
1 1 (mol)
Từ 4 PTHH trên nhận thấy nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là K2Cr2O7.
Chọn đáp án C.
Chất dùng để làm khô khí Cl2 ẩm là
Chất có thể dùng để làm khô khí Cl2 ẩm là dung dịch H2SO4 đậm đặc.
Chọn đáp án A.
Cho 1,2 gam Mg phản ứng hoàn toàn với lượng dư dung dịch HCl loãng thu được thể tích khí H2 ở đktc là?
Mg + 2HCl → MgCl2 + H2
0,05 → 0,05 (mol)
Vậy VH2 = 0,05.22,4 = 1,12 lít.
Chọn đáp án A.
Cho dung dịch muối X không màu tác dụng với dung dịch AgNO3, sản phẩm thu được có kết tủa màu vàng đậm. Dung dịch muối X là
AgNO3 + NaI → AgI (↓ vàng đậm) + NaNO3
3AgNO3 + FeCl3 → 3AgCl (↓ trắng) + Fe(NO3)3
AgNO3 + KF → không phản ứng
AgNO3 + KBr → AgBr (↓ vàng) + KNO3
Chọn đáp án A.
CaOCl2 thuộc loại muối nào trong các loại muối sau?
CaOCl2 thuộc loại muối hỗn tạp.
Chọn đáp án B.
Trong công nghiệp iot chủ yếu được sản xuất từ nguồn nguyên liệu nào?
Trong công nghiệp iot chủ yếu được sản xuất rong biển.
Chọn đáp án C.
Ở 20ºC dung dịch HCl đặc nhất có nồng độ là
Ở 20ºC dung dịch HCl đặc nhất có nồng độ là 37%.
Chọn đáp án C.
Cho 3,184g hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp; X, Y khác F) vào dung dịch AgNO3 dư thì thu được 5,734g kết tủa. Công thức của 2 muối là
Theo bài ra: X, Y khác F gọi X, Y là E (điều kiện: 35,5 < ME < 127). Ta có PTHH:
NaE + AgNO3 → AgE + NaNO3
Ta có số mol NaE = số mol AgE
Giải phương trình có ME ≈ 83,13. Vậy hai muối là NaBr và NaI.
Chọn đáp án A.
Nhận xét nào sau đây là đúng?
Nhận xét đúng là: Trong tất các các hợp chất, flo chỉ có số oxi hóa -1.
Chọn đáp án D.
Đặc điểm nào sau đây không là đặc điểm chung của tất cả các halogen?
Flo chỉ có số oxi hóa -1 trong các hợp chất.
Chọn đáp án B.
Màu của nước clo là
Màu của nước clo là màu vàng nhạt.
Chọn đáp án C.
Trong phản ứng hóa học sau: SO2 + Br2 + 2H2O → H2SO4 + 2HBr. Brom đóng vai trò là
Số oxi hóa brom giảm sau phản ứng, vậy brom đóng vai trò là chất oxi hóa.
Cho các phản ứng sau:
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O (1)
2HCl + Fe → FeCl2 + H2 (2)
2HCl + Na2O → 2NaCl + H2O (3)
2HCl + Na2SO3 → 2NaCl + SO2 + H2O (4)
Số phản ứng trong đó HCl thể hiện tính khử là
Phản ứng trong đó HCl thể hiện tính khử là: 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
Chọn đáp án D.
Khi cho dung dịch AgNO3 phản ứng với dung dịch nào sau đây sẽ không cho kết tủa?
AgNO3 + KF → không phản ứng. Chọn đáp án D.
Chất nào sau đây không có tính tẩy màu?
Chất không có tính tẩy màu là axit clohiđric.
Chọn đáp án D.
Hỗn hợp X gồm Na, Ba, Na2O, BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được 0,05mol khí hidro và dung dịch Y, trong đó có 20,52 gam Ba(OH)2. Hấp thụ hoàn toàn 0,3 mol CO2 vào Y, thu được m gam kết tủa. Tính m?
Vì trong dữ kiện cuối ta không biết CO2 có phản ứng đủ hay không → bỏ qua dữ kiện này.
Bài toán có ba dữ kiện: mX, nH2 và nBa(OH)2 trong Y. Trong khi trong hỗn hợp X lại có 4 chất → ta sẽ bỏ đi một chất nào đó. Ta có thể bỏ đi một chất bất kì và sẽ không làm thay đổi số PT cũng như bản chất bài toán. Giả sử ta muốn bỏ Na đi → hỗn hợp X có Ba, BaO và Na2O với số mol là a, b, c mol
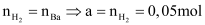 (đây là lí do ta bỏ Na, vì dựa vào
(đây là lí do ta bỏ Na, vì dựa vào  , ta sẽ xác định được ngay số mol Ba)
, ta sẽ xác định được ngay số mol Ba)
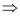 Hỗn hợp X có 0,05 mol Ba, b mol BaO và c mol Na2O
Hỗn hợp X có 0,05 mol Ba, b mol BaO và c mol Na2O
Ba(OH)2 = 0,12 mol = nBa + nBaO = 0,05 + b → b = 0,07 mol
mX = 0,05.137 + 0,07.(137 = 16) + c.(23.2 + 16) = 21,9 → c = 0,07 mol
(Các bạn hoàn toàn có thể giải 3 PT 3 ẩn, nhưng ở đây trình bày cách ngắn hơn)
Vậy đáp án đúng là A.
Cho các dung dịch: H2SO4, NaOH, NaCl, BaCl2, Na2SO4 được đựng trong các lọ riêng biệt không có nhãn. Chỉ dùng quỳ tím có thể nhận biết được tối đa bao nhiêu chất?
Dùng quỳ tím nhận biết được
+ Dung dịch H2SO4 làm quỳ tím chuyển màu đỏ.
+ Dung dịch NaOH làm quỳ tím chuyển màu xanh.
+ Dung dịch NaCl, Na2SO4 và BaCl2 không làm quỳ tím chuyển màu.
Lấy một ít dung dịch H2SO4 vừa nhận biết được cho tiếp vào 3 mẫu thử chứa NaCl, Na2SO4 và BaCl2
+ Có kết tủa trắng thì dung dịch đó là BaCl2.
+ Không có hiện tượng gì là các dung dịch Na2SO4 và NaCl.
Lấy một ít dung dịch BaCl2 vừa nhận biết được cho vào hai mẫu thử còn lại
+ có kết tủa trắng là Na2SO4
+ Không hiện tượng là NaCl
Như vậy dùng quỳ tím có thể nhận biết được 5 chất.
Đáp án D
Trong thí nghiệm, để điều chế một lượng nhỏ khí oxi người ta có thể nhiệt phân các hợp chất giàu oxi và kém bền với nhiệt như KMnO4 (rắn), KClO3 (rắn),... Cho các bước tiến hành như sau
1.Kẹp ống nghiệm lên giá, đưa ống dẫn vào miệng bình thu khí.
2.Lấy một lượng nhỏ tinh thể KMnO4 cho vào ống nghiệm, thêm một nhúm bông ở gần miệng ống nghiệm.
3.Đậy miệng ống nghiệm bằng nút cao su có kèm ống dẫn.
4.Dùng đèn cồn hơ đều ống nghiệm sau đó tập trung đun tại chỗ có KMnO4.
5.Lấy đầy nước vào các bình thu khí, sau đó úp trong chậu nước.
6.Khi đã thu đủ lượng khí cần dùng thì rút ống dẫn khí, sau đó tắt đèn cồn.
Thứ tự các thao tác tiến hành thí nghiệm là
Thứ tự các bước tiến hành thí nghiệm là:
5.Lấy đầy nước vào các bình thu khí, sau đó úp trong chậu nước.
2.Lấy một lượng nhỏ tinh thể KMnO4 cho vào ống nghiệm, thêm một nhúm bông ở gần miệng ống nghiệm.
3.Đậy miệng ống nghiệm bằng nút cao su có kèm ống dẫn.
4.Dùng đèn cồn hơ đều ống nghiệm sau đó tập trung đun tại chỗ có KMnO4.
6.Khi đã thu đủ lượng khí cần dùng thì rút ống dẫn khí, sau đó tắt đèn cồn.
Đáp án C
Cho các phản ứng hóa học sau:
\(\eqalign{ & \left( a \right)S + {O_2} \to S{O_2} \cr & \left( b \right)S + 3{F_2} \to S{F_6} \cr & \left( c \right)S + Hg \to HgS. \cr & \left( d \right)S + 6HN{O_{3\left( d \right)}} \to {H_2}S{O_4} + 6N{O_2} + 2{H_2}O \cr} \)
Số phản ứng trong đó S thể hiện tính khử là
(a) \(S + {O_2} \to S{O_2}\)
Số oxi hóa của S tăng từ 0 lên +4 nên S là chất khử.
\(\left( b \right)S + 3F{e_2} \to S{F_6}\)
Số oxi hóa của S tăng từ 0 lên +6 nên S là chất khử.
\(\left( c \right)S + Hg \to HgS\)
Số oxi hóa của S giảm từ 0 xuống -2 nên S là chất oxi hóa.
\(\left( d \right)S + HN{O_3} \to {H_2}S{O_4} + 6N{O_2} + 2{H_2}O\)
Số oxi hóa của S tăng từ 0 lên +6 nên S là chất khử.
X và Y là hai nguyên tố thuộc cùng một chu kì và ở hai nhóm A liên tiếp. Số proton của ngyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau đây về X, Y là đúng?
Vì X, Y thuộc cùng một chu kì và ở hai nhóm A liên tiếp nên số proton của chúng hơn kém nhau là 1
Theo đề bài ra ta có:
\(\left\{ \matrix{ {p_X} - {p_Y} = 1 \hfill \cr {p_y} + {p_Y} = 33 \hfill \cr} \right. \Leftrightarrow \left\{ \matrix{ {p_Y} = 17 \hfill \cr {p_X} = 16 \hfill \cr} \right.\)
Cấu hình electron của X: 1s22s22p63s23p4 \( \Rightarrow \) có 6 electron ở lớp ngoài cùng \( \Rightarrow \) X là phi kim \( \Rightarrow \) loại D.
Ở điều kiện thường X ở dạng rắn \( \Rightarrow \) loại C.
Cấu hình của Y: \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^5} \Rightarrow \) có 7 electron lớp ngoài cùng \( \Rightarrow \) Y là phi kim\( \Rightarrow \) loại B.
Đáp án A
Lấy 50 ml dung dịch HCl 1M vào một ống nghiệm rồi thả vào đó một mẩu quỳ tím. Nhỏ từ từ dung dịch KOH 2M vào ống nghiệm trên đến khi thấy màu giấy quỳ thành màu tím trở lại thì hết đúng V ml. Giá trị của V là
Ban đầu khi thả quỳ tím vào dung dịch HCl thì quỳ tím chuyển sang màu đỏ. Nhỏ dung dịch KOH vào thì màu đỏ nhạt dần cho đến khi dung dịch axit trung hòa hết thì giấy quỳ lại trở về màu tím.
NHCl = 0,05 mol
Phương trình hóa học:
\(\eqalign{ & {\rm{ HCl + KOH}} \to {\rm{KCl + }}{{\rm{H}}_2}O \cr & {\rm{ 0,05}} \to {\rm{0,05 mol}} \cr & \to {{\rm{V}}_{KOH}} = {n \over {{C_M}}} = {{0,05} \over 2} = 0,25\left( l \right) = 25\left( {ml} \right) \cr} \)
Đáp án C
Hấp thụ hoàn toàn 6,4 gam SO2 vào 150 ml dung dịch NaOH 2M thu được dung dịch X. Thành phần của dung dịch X là
\(\eqalign{ & {n_{S{O_2}}} = 0,1mol;{n_{NaOH}} = 0,3mol \cr & \to {{{n_{NaOH}}} \over {{n_{S{O_2}}}}} = {{0,3} \over {0,1}} = 3 > 2 \cr} \)
\( \Rightarrow \) sinh ra hai muối trung hòa và NaOH dư.
Vậy dung dịch X gồm Na2SO3 và NaOH.
Đáp án A
Cho các nguyên tố 20Ca, 12Mg, 13Al, 15P. Thứ tự tính kim loại giảm dần là
Mg, Al, P cùng thuộc một chu kì \( \Rightarrow \) tính kim loại Mg > Al > P (1)
Mg và Ca cùng thuộc một nhóm A \( \Rightarrow \) tính kim loại Mg < Ca (2)
Từ (1) và (2) \( \Rightarrow \) tính kim loại của Ca > Mg > P.
Đáp án A
Quá trình nào sau đây không sinh ra khí oxi?
\(\eqalign{ & Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + {H_2}O \cr & 2{H_2}O\buildrel {dp} \over \longrightarrow 2{H_2} + {O_2} \cr & 2KCl{O_3}\mathrel{\mathop{\kern0pt\longrightarrow} \limits_{t^\circ }^{Mn{O_2}}} 2KCl + 3{O_2} \cr & 6C{O_2} + 6{H_2}O \to {C_6}{H_{12}}{O_6} + 6{O_2} \cr} \)
Đáp án A
Cho các nhận định sau
(1) Iot tan nhiều trong ancol etylic tạo thành cồn iot để sát trùng.
(2) Số oxi hóa của N trong NH4+ và NH3 đều là -3.
(3) H2S là một khí độc, không màu, mùi trứng thối.
(4) Axit sunfuric đặc có tính háo nước nên được sử dụng để làm khô một số khí như O2, CO2...
(5) Flo có thể tan trong nước tạo thành nước flo.
(6) Khi cho khí clo tác dụng với vôi tôi hoặc sữa vôi ở nhiệt độ thường ta thu được clorua vôi.
Số nhận định đúng là
(1) Iot tan nhiều trong ancol etylic tạo thành cồn iot để sát trùng: Đúng.
(2) Số oxi hóa của N trong NH4+ và NH3 đều là -3: Đúng.
(3) H2S là một khí độc, không màu, mùi trứng thối: Đúng.
(4) Axit sunfuaric đặc có tính háo nước nên được sử dụng để làm khô một số khí như O2, CO2: Đúng.
(5) Flo có thể tan trong nước tạo thành nước flo: Sai, vì flo có tính oxi hóa mạnh nên oxi hóa nước ngay ở nhiệt độ thường:
\(2{F_2} + {H_2}O \to 4HF + {O_2}\)
Do đó, không tạo được nước flo.
(6) Khi cho khí clo tác dụng với vôi tôi hoặc sữa vôi ở nhiệt độ thường ta thu được clorua vôi: Sai, vì để tạo thành clorua vôi cần nhiệt độ cao.
Các nhận định đúng là (1), (2), (3), (4)
Đáp án D
Nguyên tố X thuộc nhóm VIIA trong bảng tuần hoàn. Trong hợp chất khí của X với hidro (hợp chất Y) thì X chiếm 97,26% về khối lượng. X là
X thuộc nhóm VIIA \( \Rightarrow \) công thức hợp chất của X với hiđro là HX.
\(\% X = \dfrac{{{M_X}}}{{{M_X} + 1}}.100 \)
\(\Leftrightarrow 97,26 = \dfrac{{{M_X}}}{{{M_X} + 1}}.100\)
\(\Rightarrow {M_X} = 35,5\)
Vậy nguyên tố X cần tìm là clo (Cl)
Đáp án B
Cho cân bằng trong bình kin sau: \(2N{O_{2\left( k \right)}} \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {N_2}{O_{4\left( k \right)}}\)
(màu nâu đỏ) (không màu)
Biết rằng khi tăng nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng nghịch có
\(2N{O_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {N_2}{O_4}\left( k \right)\)
Màu nâu đỏ không màu
Khi tăng nhiệt độ, màu nâu đỏ nhạt dần chứng tỏ cân bằng chuyển dịch theo chiều thuận.
Vậy chiều thuận là phản ứng thu nhiệt, \(\Delta H > 0\). Do đó phản ứng nghịch là phản ứng tỏa nhiệt, \(\Delta H < 0.\)
Đáp án B
Công thức của oleum là:
Công thức của oleum là H2SO4.nSO3
Đáp án C
Tác nhân chủ yếu gây mưa axit là
Tác nhân chủ yếu gây mưa axit là SO2 và NO2.
Đáp án D

