Đề thi HK2 môn Hóa học 12 năm 2021-2022 - Trường THPT Nguyễn Trung Trực
Đề thi HK2 môn Hóa học 12 năm 2021-2022 - Trường THPT Nguyễn Trung Trực
-
Hocon247
-
40 câu hỏi
-
60 phút
-
65 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Phản ứng hoá học nào dưới đây không thuộc loại phản ứng nhiệt nhôm ?
Phản ứng nhiệt nhôm là cho nhôm khử các oxit của kim loại => Phản ứng hoá học không thuộc loại phản ứng nhiệt nhôm là Al tác dụng với axit H2SO4 đặc, nóng.
Đáp án cần chọn là: D
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol NaOH và b mol NaAlO2, kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
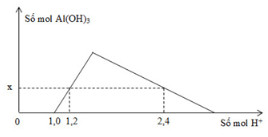
Tổng giá trị (a + b) là
Thứ tự phản ứng: H+ + OH- → H2O
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
- Tại: nH+ = 1,0 mol ⟹ bắt đầu có kết tủa ⟹ Phản ứng trung hòa hoàn toàn ⟹ nOH = 1 mol = a
- Tại nH+ = 1,2 mol ⟹ chưa có hiện tượng hòa tan kết tủa ⟹ nAl(OH)3 = nH+ pứ = 1,2 - 1 = 0,2 mol
- Tại nH+ = 2,4 mol ⟹ có hiện tượng hòa tan 1 phần kết tủa ⟹ nAl(OH)3 = 1/3.(4nAlO2 - nH+ pứ)
⟹ 0,2 = 1/3.[4b - (2,4 - 1,0)] ⟹ b = 0,5 mol
⟹ (a + b) = 1,5 mol.
Cho hình vẽ mô tả thí nghiệm điều chế kim loại bằng phương pháp nhiệt luyện:
.jpg)
Trong hình vẽ trên, oxit X là
- Khi cho Zn phản ứng với HCl sinh ra H2: Zn + 2HCl → ZnCl2 + H2.
- H2 sinh ra chỉ khử được CuO.
Cho dãy các kim loại: Li, Na, Al, Ca . Số kim loại kiềm trong dãy là
Có 2 kim loại kiềm là Li, Na
Đáp án B
Chất không có tính lưỡng tính là
AlCl3 không thể nhận proton (H+) nên không phải là chât lưỡng tính
Đáp án D
Chất X là 1 kim loại nhẹ, màu trắng bạc được ứng dụng rộng rãi trong đời sống. Chất X là:
Al là 1 kim loại nhẹ, màu trắng bạc được ứng dụng rộng rãi trong đời sống
Đáp án B
Dẫn khí CO dư qua hỗn hợp bột Al2O3, Fe2O3 đun nóng đến khi phản ứng hoàn toàn thu được hỗn hợp rắn gồm:
Chất khử trung bình (C, CO, H2) chỉ khử được những oxit của những kim loại đứng sau Al trong dãy điện hóa.
Do đó CO chỉ có thể khử được oxit Fe2O3 thành Fe
=> Hỗn hợp rắn gồm: Al2O3, Fe
Đáp án C
Cấu hình electron của Cr3+ là:
24Cr: 1s22s22p63s23p63d54s1
=> 24Cr3+: 1s22s22p63s23p63d3 hay [Ar] 3d3
Đáp án D
Để điều chế dung dịch muối sắt (III) clorua bằng 1 phản ứng hóa học, người ta cho dung dịch HCl tác dụng với:
Để điều chế muối sắt (III) cần dùng HCl tác dụng với oxit sắt (III)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Đáp án C
Chất nào sau đây thuộc nhóm kim loại kiềm:
K thuộc nhóm kim loại kiềm
Đáp án D
Khí thải ở một nhà máy có chứa CO2, NO2, N2 và SO2 được sục vào dung dịch Ca(OH)2 dư (có phản ứng xảy ra hoàn toàn), khí không bị hấp thụ là:
CO2, NO2, SO2 đều phản ứng với Ca(OH)2
CO2 + Ca(OH)2 → CaCO3 + H2O
SO2 + Ca(OH)2 → CaSO3 + H2O
4NO2 + 2Ca(OH)2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Chỉ có N2 không có phản ứng.
Đáp án C
Dùng X để làm mềm nước cứng có tính cứng vĩnh cửu và tạm thời. X là:
Na2CO3 có thể được sử dụng để làm mềm nước cứng tạm thời và vĩnh cửu.
Đáp án D
Sục hoàn toàn 6,72 lít khí CO2 (đktc) vào 0,25 lít dung dịch Ca(OH)2 1M thu được bao nhiêu gam kết tủa?
nCO2 = 6,72: 22,4 = 0,3 mol
nCa(OH)2 = 0,25.1 = 0,25 mol => nOH = 2nCa(OH)2 = 0,5 mol
Ta thấy: nCO2 < nOH < 2nCO2 => phản ứng tạo hỗn hợp muối HCO3 và CO3
=> nCO3 = nOH – nCO2 = 0,5 – 0,3 = 0,2 mol < nCa2+
=> nCaCO3 = nCO3 = 0,2 mol
=> mkết tủa = 0,2. 100 = 20g
Đáp án D
Cho các dung dịch sau: NaOH; Na2CO3; NaHSO4; Na2SO4. Dung dịch làm cho quỳ tím đổi màu xanh là
Quỳ tím → xanh: NaOH, Na2CO3
Quỳ tím → đỏ: NaHSO4
Quỳ tím không đổi màu: Na2SO4
Đáp án A
Cấu hình electron nào sau đây là của Fe?
26Fe có cấu hình e là: 1s22s22p63s23p63d64s2
Đáp án B
Cho 4,6 gam Na tác dụng hoàn toàn với nước. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là
nNa = 4,6: 23 = 0,2 mol
Na + H2O → NaOH + 0,5H2
Mol 0,2 → 0,1
=> VH2 = 0,1.22,4 = 2,24 lit
Đáp án D
Các hợp chất sau: CaO, CaSO4.2H2O, Ca(OH)2 có tên lần lượt là:
CaO: vôi sống
CaSO4.2H2O: thạch cao
Ca(OH)2: vôi tôi
Đáp án B
Hòa tan hoàn toàn 20 gam CaCO3 trong dung dịch HCl. Dẫn toàn bộ khí thu được vào 100 ml dung dịch NaOH 2,5M, sau phản ứng thu được muối
nCaCO3 = 20: 100 = 0,2 mol
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Mol 0,2 → 0,2
nNaOH = 0,1.2,5 = 0,25 mol
Ta thấy: nCO2 < nNaOH < 2nCO2 => phản ứng tạo hỗn hợp muối NaHCO3 và Na2CO3
Đáp án C
Cho dãy các chất: Al, Al(OH)3, Zn(OH)2, NaHCO3, Na2SO4. Số chất trong dãy vừa phản ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH là
Chỉ có Na2SO4 là không phản ứng với NaOH và HCl
- Với NaOH: Al + NaOH + H2O → NaAlO2 + 1,5H2
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
NaHCO3 + NaOH → Na2CO3 + H2O
- Với HCl: Al + 3HCl → AlCl3 + 1,5H2
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
Đáp án C
Cho 31,2g hỗn hợp bột Al và Al2O3 tác dụng với dung dịch NaOH dư thu được 13,44 lít H2 (đktc). Phần trăm khối lượng của Al2O3 trong hỗn hợp là
nH2 = 13,44: 22,4 = 0,6 mol
- Các phản ứng:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al + NaOH → NaAlO2 + 1,5H2
Mol 0,4 0,6
=> %mAl = 0,4.27 / 31,2 = 34,6%
=> %mAl2O3 = 100 % - %mAl = 100% - 34,6% = 65,4%
Đáp án C
Phản ứng nào sau đây giải thích sự tạo thành thạch nhũ trong hang động?
Phản ứng giải thích sự hình thành thạch nhũ trong hang động:
Ca(HCO3)2 → CaCO3 + CO2 + H2O.
Đáp án C
Hóa chất được dùng trong công nghiệp dược phẩm (chế thuốc đau dạ dày, …) và công nghiệp thực phẩm có công thức hóa học là
NaHCO3 được dùng để điều chế thuốc chữa đau dạ dày do thừa axit trong dạ dày:
NaHCO3 + H+ → Na+ + H2O + CO2
Đáp án D
Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là
Na, Ba, K là các kim loại phản ứng được với nước ở nhiệt độ thường
Đáp án A
Hòa tan hết 5,6 gam Fe trong 400 ml dung dịch HCl 1M thu được dung dịch X. Cho dung dịch X tác dụng với dung dịch AgNO3 dư, sau khi kết thúc phản ứng thu được khí NO duy nhất, đung dịch Y và m gam kết tủa. Giá trị của m là
nFe = 5,6 : 56 = 0,1 mol ; nHCl = 0,4.1 = 0,4 mol
Fe + 2HCl → FeCl2 + H2
Mol 0,1 → 0,2 → 0,1 → nHCl dư = 0,4 – 0,2 = 0,2 mol
- Khi cho AgNO3 dư vào thì có phản ứng:
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
Mol 0,1 → 0,4/3 (< 0,2) → H+ dư, không còn Fe2+.
Ag+ + Cl- → AgCl
Bảo toàn nguyên tố Clo: nCl = nHCl ban đầu = 0,4 mol
→ nAgCl = 0,4 mol => m = 0,4.143,5 = 57,4g
Đáp án C
Cho sơ đồ chuyển hoá: Fe \(\buildrel {{X}} \over\longrightarrow \) FeCl3 \(\buildrel {{Y}} \over\longrightarrow \) Fe(OH)3 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là
X là: Cl2 ; Y là NaOH
(Vì chỉ Cl2 mới oxi hóa được Fe lên Fe3+, H+ chỉ oxi hóa lên Fe2+)
Fe + 1,5Cl2 \(\buildrel {{t^0}} \over\longrightarrow \) FeCl3
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Đáp án D
Trong các nguồn năng lượng sau đây, các nguồn năng lượng nào được coi là năng lượng sạch?
Năng lượng gió, năng lượng thủy triều được coi là nguồn năng lượng sạch
Đáp án D
Điện phân dung dịch X chứa m gam CuSO4 và 0,2 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi). Trong thời gian t giây, thu được 2,464 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả hai điện cực là 5,824 lít (đktc). Biết hiệu suất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m là:
Các quá trình có thể xảy ra ở 2 điện cực:
+) Catot: Cu2+ + 2e → Cu
2H2O + 2e → 2OH- + H2
+) Anot: 2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
- Khi điện phân trong t giây:
nkhí Anot = 2,464: 22,4 = 0,11 mol
nCl2 = 0,5nCl- = 0,1 mol < 0,11 => Nước đã bị điện phân ở Anot
=> nO2 = nkhí anot – nCl2 = 0,11 – 0,1 = 0,01 mol
=> ne trao đổi = 2nCl2 + 4nO2 = 2.0,1 + 4.0,01 = 0,24 mol
- Khi điện phân trong 2t giây:
=> Số mol electron trao đổi sẽ gấp đôi: ne trao đổi = 2.0,24 = 0,48 mol
+) Tại Anot: nCl2 = 0,1 mol
Có: ne = 2nCl2 + 4nO2 => nO2 = ¼ (0,48 – 2.0,1) = 0,07 mol
=> nkhí Anot = nCl2 + nO2 = 0,1 + 0,07 = 0,17 mol
nkhí = 5,824: 22,4 = 0,26 mol > 0,17 => Nước bị điện phân ở Catot
=> nH2(Catot) = 0,26 – 0,17 = 0,09 mol
- Bảo toàn e: ne trao đổi = 2nCu2+ + 2nH2 = 4nO2 + 2nCl2
=> nCu2+ = ½ (4.0,07 + 2.0,1 – 2.0,09) = 0,15 mol
=> m = mCuSO4 = 160.0,15 = 24g
Đáp án B
Nhỏ từ từ dung dịch Ba(OH)2 vào ống nghiệm chứa dung dịch HCl và Al2(SO4)3. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau:
.jpg)
Giá trị nào của mmax - mmin sau đây là đúng?
Phản ứng: Ba2+ + SO42- → BaSO4
H+ + OH- → H2O
Al3+ + OH- → Al(OH)3
Al(OH)3 + OH- → AlO2- + 2H2O
- Dựa vào đồ thị ta thấy: Trong khi Ba2+ tạo kết tủa ngay từ ban đầu thì OH- lại phải trung hòa H+ trước rồi mới tạo kết tủa sau. Do đó Ba2+ sẽ đến đích(tạo kết tủa max) trước OH-.
+) Giai đoạn1: Ba2+ tạo kết tủa, OH- trung hòa H+
+) Giai đoạn 2: Ba2+ tạo kết tủa nốt phần còn lại, OH- bắt đầu kết hợp tạo Al(OH)3:
⟹ Tại nBa(OH)2 = 0,27 mol thì kết tủa BaSO4 đạt max ⟹ nBa(OH)2 = nBaSO4 = 0,27 mol = nSO4
⟹ nAl2(SO4)3 = 1/3nSO4 = 0,09 mol ⟹ nAl3+ = 2.0,09 = 0,18 mol
+) Giai đoạn 3: Chỉ có OH- tạo tiếp kết tủa.
⟹ Tại nBa(OH)2 = 0,47 mol thì kết tủa Al(OH)3 đạt max
⟹ nAl(OH)3 = nAl3+
+) Giai đoạn 4: Al(OH)3 bị hòa tan dần và khi mkết tủa min là lúc Al(OH)3 bị hòa tan hết
- Vậy: kết tủa max gồm: 0,27 mol BaSO4 và 0,18 mol Al(OH)3
kết tủa min gồm: 0,27 mol BaSO4
⟹ mmax - mmin = mAl(OH)3 = 0,18.78 = 14,04 gam.
Cho 15g một kim loại nhóm IIA tác dụng hết với H2O thu được 9,165 lít H2 (250C và 1atm). Kim loại đó là:
- Phản ứng: A + 2H2O → A(OH)2 + H2
nH2 = 1.9,165: (0,082.298) = 0,375 mol
=> nA = nH2 = 0,375 mol
=> MA = 15: 0,375 = 40 g/mol (Ca)
Đáp án C
Hòa tan 2,84 gam hỗn hợp CaCO3 và MgCO3 vào dung dịch HCl dư, thấy thoát ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của CaCO3 là:
- Các phản ứng:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
nCO2 = 0,672: 22,4 = 0,03 mol = nCaCO3 + nMgCO3
Lại có: mhh muối = mCaCO3 + mMgCO3 => 100nCaCO3 + 84nMgCO3 = 2,84
=> nCaCO3 = 0,02 ; nMgCO3 = 0,01 mol
=> %mCaCO3 = 100.0,02 / 2,84 = 70,42%
Đáp án D
Hòa tan hoàn toàn 2,16 gam kim loại R trong H2SO4 đặc, nóng thu được dung dịch X và 0,224 lít khí SO2 (đkc). R là kim loại nào sau đây? (Fe=56; Cu=64; Cr=52; Ag=108)
Giả sử R khi phản ứng với H2SO4 tạo ra ion Rn+ có số oxi hóa là +n
- Quá trình trao đổi e: R → R+n + ne
S+6 + 2e → S+4
=> bảo toàn e: nR.n = 2nSO2 = 2.0,224/22,4 = 0,02 mol
Mà nR = mR / MR = 2,16 / R
=> n.2,16/R = 0,02
=> R = 108n => Với n = 1 thì R = 108 g/mol (Ag)
Đáp án D
Khử hoàn toàn 12,32 gam hỗn hợp gồm Fe, FeO, Fe3O4, Fe2O3 bằng khí CO. Khí đi ra sau phản ứng được dẫn vào dung dịch Ca(OH)2 dư thấy tạo ra 7 gam kết tủa. Khối lượng Fe thu được là: (Fe=56;S=32; O=16; H=1; Ca=40; C=12)
- Qui hỗn hợp ban đầu là FexOy
FexOy + yCO \(\buildrel {{t^0}} \over\longrightarrow \) xFe + yCO2
CO2 + Ca(OH)2 → CaCO3 + H2O
- Ta thấy nCO2 = nCaCO3 = 7/100 = 0,07 mol
BTKL: m hh đầu + mCO = mFe + mCO2 => 12,32 + 0,07.28 = mFe + 0,07.44 => mFe = 12,32 – 0,07.16 = 11,2g
Đáp án C
Cho dãy các chất: Cr(OH)3, CrO3, Zn(OH)2 , NaHCO3, Al2O3. Số chất trong dãy tác dụng được với dung dịch NaOH (đặc, nóng) là:
Các phản ứng:
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
CrO3 + 2NaOH → Na2CrO4 + H2O
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
NaHCO3 + NaOH → Na2CO3 + H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
=> Cả 5 chất đều phản ứng
Đáp án B
Trong các cấu hình electron của nguyên tử và ion crom sau đây, cấu hình electron nào không đúng?
24Cr: 1s22s22p63s23p63d54s1
- Đáp án D sai vì cấu hình e 3d44s2 là trạng thái không bền, chuyển thành 3d54s1 (đây được gọi là trạng thái bán bão hòa)
Đáp án D
Oxi hoá chậm m gam Fe ngoài không khí thu được 12 gam hỗn hợp A gồm FeO, Fe2O3, Fe3O4 và Fe dư. Hoà tan A bằng lượng vừa đủ 200 ml dd HNO3 thu được 2,24 lít NO duy nhất đktc. Tính m và CM dd HNO3 (Fe=56;O=16; N=14; H=1)
Qui hỗn hợp về dạng: Fe và O => mFe + mO = 12g (1)
nNO = 2,24: 22,4 = 0,1 mol
Bảo toàn e: 3nFe = 2nO + 3nNO => 3nFe – 2nO = 0,3 mol (2)
Từ (1,2) => nFe = 0,18 ; nO = 0,12 mol
=> nHNO3 = 4nNO + 2nO = 4.0,1 + 2.0,12 = 0,64 mol
=> CM (HNO3) = 0,64: 0,2 = 3,2 M
m = mFe = 0,18.56 = 10,08g
Đáp án C
Hòa tan m gam nhôm vào dung dịch HNO3 loãng, thu được hỗn hợp khí gồm 0,15 mol N2O và 0,1 mol NO (không tạo ra NH4+). Giá trị của m là:
ne = 3nAl = 3nNO + 8nN2O = 3.0,1 + 8.0,15 = 1,5 mol => nAl = 0,5 mol
=> m = mAl = 27.0,5 = 13,5g
Đáp án D
Cho khí CO dư khử hoàn toàn 46,4g hỗn hợp gồm FeO, Fe2O3, Fe3O4 thu được m gam Fe kim loại. Hỗn hợp khí sinh ra được dẫn vào dung dịch Ca(OH)2 dư thu được 80g kết tủa. Giá trị m là
Tổng quát: CO + Ooxit → CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
Có: nCaCO3 = 80: 100 = 0,8 mol = nCO2 = nO (Oxit)
=> mKL = mOxit – mO(Oxit) = 46,4 – 0,8.16 = 33,6g
Đáp án C
Chất nào sau đây làm tăng hiệu ứng nhà kính nhiều nhất
CO2 là nguyên nhân chủ yếu gây nên hiệu ứng nhà kính.
Đáp án D
Sục V lít CO2 (đktc) vào dung dịch Ca(OH)2 dư đến khi phản ứng kết thúc thu được 20 gam kết tủa. Giá trị V là
nCaCO3 = 20: 100 = 0,2 mol. Vì Ca(OH)2 dư nên chỉ có phản ứng tạo muối trung hòa.
Ca(OH)2 + CO2 → CaCO3 + H2O
Mol 0,2 0,2
=> VCO2 = 0,2.22,4 = 4,48 lit
Đáp án B
Kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy
Các kim loại kiềm, kiềm thổ và nhôm được điều chế bằng phương pháp điện phân nóng chảy.
Đáp án A

