Đề thi HK2 môn Hóa học 12 năm 2021-2022 - Trường THPT Nguyễn Khuyến
Đề thi HK2 môn Hóa học 12 năm 2021-2022 - Trường THPT Nguyễn Khuyến
-
Hocon247
-
40 câu hỏi
-
60 phút
-
61 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Cho các kim loại sau: Al, Cu, Mg, Fe, Zn, K. Số kim loại phản ứng được với cả dung dịch H2SO4 loãng và H2SO4 đặc nguội ?
Các kim loại đứng sau H trong dãy hoạt động hóa học thì không tác dụng với H2SO4 loãng => loại Cu
Al, Fe không tác dụng với H2SO4 đặc nguội
Đáp án cần chọn là: C
Cho các phương pháp: (1) đun nóng trước khi dùng; (2) dùng dung dịch Ca(OH)2 vừa đủ; (3) dùng dung dịch Na2CO3; (4) dùng dung dịch NaCl; (5) dùng dung dịch HCl. Chất không dùng làm mềm nước cứng tạm thời?
Nước cứng tạm thời chứa Ca(HCO3)2 và Mg(HCO3)2.
=> đun nóng hoặc dùng dung dịch Ca(OH)2 vừa đủ hoặc Na2CO3 để làm mềm nước cứng tạm thời
=> Chất không dùng làm mềm nước cứng tạm thời là dung dịch NaCl và dung dịch HCl
Đáp án cần chọn là: C
Cho 1 lượng Fe phản ứng hết với dung dịch H2SO4 đặc nóng dư, sau phản ứng thu được 3,36 lít khí SO2 (đktc) và m gam muối khan. Giá trị của m là
nSO2 = 0,15 mol => ne nhận = 2nSO2 = 0,3 mol
=> nFe = necho / 3 = ne nhận / 3 = 0,1 mol
\(nSO_4^{2 - } = \frac{{{n_{e\;cho}}}}{2}\) = 0,15 mol
=> mmuối = mFe + mSO4 = 0,1.56 + 0,15.96 = 20 gam
Đáp án cần chọn là: A
Phương trình điện phân dung dịch CuSO4 với điện cực trơ là
Phương trình điện phân dung dịch CuSO4: 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Đáp án cần chọn là: D
Có thể phát hiện ra dấu vết của nước trong ancol etylic bằng cách dùng
Có thể phát hiện ra dấu vết của nước trong ancol etylic bằng cách dùng CuSO4 khan vì
CuSO4 + nH2O → CuSO4.nH2O
Trắng xanh
Đáp án cần chọn là: B
Khẳng định nào sau đây đúng khi nói về tính chất của nhôm?
A sai nhôm là kim loại nhẹ
B sai nhôm tác dụng yếu với nước do tạo màng oxit
C đúng những vật bằng nhôm hàng ngày tiếp xúc với nước dù ở nhiệt độ nào cũng không xảy ra phản ứng vì trên bề mặt vật được phủ một lớp nhôm oxit mỏng, bền, ngăn cách vật với nước.
D sai vì nhôm là kim loại nhóm IIIA.
Đáp án cần chọn là: C
Trong các kim loại: Na, Mg, Al, Fe, Cu. Có bao nhiêu kim loại có thể tan hoàn toàn trong lượng dư dung dịch NaOH?
Kim loại tan được trong lượng dư dung dịch NaOH là: Na, Al → 2 kim loại
2Na + 2H2O → 2NaOH + H2
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Đáp án cần chọn là: D
Phát biểu nào sau đây là đúng khi nói về ăn mòn hoá học ?
A sai vì ăn mòn hóa học không làm phát sinh dòng điện.
B sai vì kim loại tinh khiết vẫn có thể bị ăn mòn hóa học.
C sai vì ăn mòn hóa học không phải là ăn mòn điện hóa.
D đúng
Đáp án cần chọn là: D
Hòa tan hoàn toàn 8,96 gam Fe trong dung dịch H2SO4 dư. Khối lượng muối sinh ra là
nFe = 0,16 mol
Bảo toàn nguyên tố : nFeSO4 = nFe = 0,16 mol
=> mFeSO4 = 0,16.152 = 24,32 gam
Đáp án cần chọn là: A
Cho phản ứng hóa học : Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
Quá trình nhường electron là sự oxi hóa, quá trình nhận electron là sự khử
Fe + CuSO4 → FeSO4 + Cu
Fe→Fe2++2e (sự oxi hóa)
Cu2+ +2e→Cu (sự khử)
Đáp án cần chọn là: D
Một cation kim loại M có cấu hình e ở lớp ngoài cùng là 2s22p6. Vậy cấu hình e ở lớp ngoài cùng của nguyên tử kim loại M là :
Cấu hình electron của kim loại có thể có 1, 2 hoặc 3 electron lớp ngoài cùng
=> các trường hợp thỏa mãn là
1s22s22p63s1
1s22s22p63s2
1s22s22p63s23p1
Đáp án cần chọn là: D
Hãy chọn phản ứng giải thích sự xâm thực của nước mưa với đá vôi và sự tạo thành thạch nhũ trong các hang động?
Phản ứng giải thích sự xâm thực của nước mưa với đá vôi và sự tạo thành thạch nhũ trong các hang động là quá trình phản ứng thuận nghịch: CaCO3 + H2O + CO2 ⇆ Ca(HCO3)2 xảy ra trong 1 thời gian rất lâu
Đáp án cần chọn là: D
Phản ứng hóa học nào sau đây chỉ thực hiện được bằng phương pháp điện phân?
- Phản ứng A và D là phương pháp thủy luyện
- Phản ứng C là dung dịch muối tác dụng với dung dịch bazơ
- Phản ứng B là điện phân muối CuSO4 trong nước
Đáp án cần chọn là: B
Cho các kim loại sau: Mg, Al, Cu, Cr, Ag. Số kim loại nào không tác dụng được với O2?
Kim loại không tác dụng được với O2 là Ag
Đáp án cần chọn là: A
Nguyên tử của nguyên tố sắt có
- Cấu hình electron: 1s22s22p63s23p63d64s2
=> sắt có 6 electron d
Đáp án cần chọn là: B
Cho hỗn hợp Al, Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 được dung dịch X và chất rắn Y gồm 3 kim loại. Chất rắn Y gồm
Al, Fe phản ứng với hai muối thu hai kim loại Cu, Ag
Al phản ứng với hai muối trước. Thu được ba kim loại → Fe dư
Sau phản ứng ba kim loại là Fe, Cu, Ag
Đáp án cần chọn là: B
lon Mg2+ bị khử trong trường hợp
lon Mg2+ bị khử trong trường hợp : Điện phân MgCl2 nóng chảy.
Đáp án cần chọn là: B
Sau một thời gian điện phân 200 ml dung dịch CuCl2 người ta thu được 1,12 lít khí (đktc) ở anot. Ngâm đinh sắt sạch trong dung dịch còn lại sau khi điện phân. Phản ứng xong, nhận thấy khối lượng đinh sắt tăng thêm 1,2 gam. Nồng độ mol ban đầu của dung dịch CuCl2 là
Phương trình điện phân :
CuCl2 → Cu + Cl2
0,05 ← 0,05
Gọi nCuCl2 dư = a mol
CuCl2 + Fe → FeCl2 + Cu
a a a
=> 64a – 56a = 1,2 => a = 0,15
=> nCuCl2 = a + 0,05 = 0,15 + 0,05 = 0,2 mol
=> CM CuCl2 = 0,2 / 0,2 = 1M
Đáp án cần chọn là: A
Cho các trường hợp sau:
1, Cho kim loại Zn vào dung dịch HCl.
2, Dây phơi quần áo bằng Fe trong không khí ẩm.
3, Nhúng thanh Fe trong dung dịch CuSO4
4, Cho kim loại Cu vào dung dịch HNO3 loãng.
5, Thép (chứa C) để trong không khí ẩm.
Số trường hợp xảy ra ăn mòn điện hóa là?
1, 2, 4 không xảy ra ăn mòn điện hóa vì đây là những quá trình ăn mòn hóa học
Đáp án cần chọn là: B
Cho 8,40 gam sắt vào 300 ml dung dịch AgNO3 1,3 M. Lắc kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
nFe = 0,15 mol; nAgNO3 = 0,39 mol
Ta thấy ne Fe cho tạo thành Fe2+ = 0,15.2 = 0,3 mol < ne Ag+ nhận = 0,39 < ne Fe cho tạo thành Fe3+ = 0,15.3 = 0,45
=> phản ứng tạo 2 muối Fe(NO3)2 và Fe(NO3)3
=> Ag+ phản ứng tạo hết thành Ag
=> nAg = nAgNO3 = 0,39 mol => m = 42,12 gam
Đáp án cần chọn là: B
Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
nFe = 0,04 mol; nCuSO4 = 0,01 mol
Fe + CuSO4 → FeSO4 + Cu
0,01 ← 0,01 → 0,01
=> độ tăng khối lượng = mCu – mFe = 0,01.(64 – 56) = 0,08 gam
=> mchất rắn Y = 2,24 + mtăng = 2,24 + 0,08 = 2,32 gam
Đáp án cần chọn là: B
Đun 0,04 mol hỗn hợp gồm hơi nước và khí CO2 qua cacbon nung đỏ, thu được 0,07 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y đi qua ống đựng 20 gam hỗn hợp gồm Fe2O3 và CuO (dư, nung nóng), sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là
Nhận thấy, C là nguyên nhân làm cho số mol hỗn hợp khí tăng lên => nC = 0,07 - 0,04 = 0,03 mol
Sau khi cho Y tác dụng với Fe2O3, CuO dư tạo thành H2O, CO2 nên ta có thể coi hỗn hợp Y gồm {H2O, CO2, C} như vậy ta thấy chỉ có C có phản ứng: C + 2O → CO2
=> nO(pư) = 2nC = 0,06 mol
=> m chất rắn = mFe2O3, CuO - mO(pư) = 20 - 0,06.16 = 19,04 gam
Đáp án cần chọn là: C
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị hai không đổi trong hợp chất) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (ở đktc). Kim loại M là
Áp dụng định luật bảo toàn khối lượng:
→mO2+mCl2=23−7,2=15,8gam
x+y=5,6 : 22,4 = 0,25 và 32x+71y=15,8
→x=0,05 và y=0,2
→ne trao đổi = 4nO2+2nCl2 =4.0,05+2.0,2=0,6mol
M=m : n = 12.hóa trị
→ Hóa trị = 2, M = 24 → M là Mg
Đáp án cần chọn là: A
Điện phân 800 ml dung dịch gồm NaCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 9,65A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị dưới đây (giả sử muối đồng không bị thủy phân):
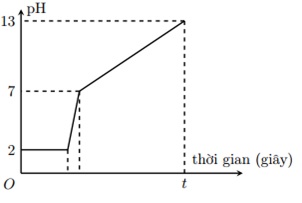
Giá trị của t trên đồ thị là
* Giai đoạn 1: pH = 2 => [H+] = 0,01 => nHCl = 0,008 (mol)
* Giai đoạn 3: pH = 13 => [OH-] = 0,1 => nNaOH = 0,08 (mol) => nNaCl = 0,08 (mol)
nCuCl2 = 0,08*0,02 = 0,016 (mol)
=> nCl- = 2 * nCuCl2 + nHCl + nNaOH = 0,12 (mol)
Vì ở giai đoạn 3, nước đã bị điện phân bên catot (sinh ra OH-) nên bên anot chỉ có Cl- điện phân.
=> nCl- = ne trao đổi = 0,12 (mol)
=> ne trao đổi = It/F => t = 1200s
Đáp án cần chọn là: C
Trộn 21,6 gam bột Al với m gam hỗn hợp X gồm (FeO, Fe2O3 và Fe3O4) được hỗn hợp Y. Nung Y ở nhiệt độ cao trong điều kiện không có không khí đến phản ứng hoàn toàn thu được chất rắn Z. Cho Z tác dụng vớii dung dịch NaOH dư thu được 6,72 lít khí. Nếu cho Z tác dụng với HNO3, loãng dư thì thu được 19,04 lít khí NO là sản phẩm khử duy nhất. Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Giá trị của m là
nAl bđ = 21,6 : 27 = 0,8 mol
- Do Z tác dụng với NaOH thu được khí H2 => Z có chứa Al => Al dư, các oxit sắt hết
2Al + 3FexOy to→ yAl2O3 + 3xFe (1)
Chất rắn Y: Fe, Al2O3, Al dư
Aldư + NaOH + H2O → NaAlO2 + 1,5H2↑ (2)
0,2 ← 0,3
- Khi cho Z tác dụng với HNO3:
Bảo toàn electron: 3nAl + 3nFe = 3nNO => nAl + nFe = nNO hay 0,2 + nFe = 0,85 => nFe = 0,65 (mol)
BTNT "Al": nAl2O3 = (nAl bđ - nAl dư)/2 = (0,8 - 0,2)/2 = 0,3 mol
BTNT "O": nO(X) = 3nAl2O3 = 0,9 mol
=> m = mFe + mO = 0,65.56 + 0,9.16 = 50,8(gam)
Đáp án cần chọn là: A
Tính thể tích của dung dịch K2Cr2O7 0,05M vừa đủ phản ứng với dung dịch chứa 0,06 mol FeSO4 trong môi trường H2SO4 dư.
Phương trình hóa học:
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + K2SO4 + 3Fe2(SO4)3 + 7H2O
0,01 ← 0,06 (mol)
⟹ VK2Cr2O7 = 0,2 lít = 200 (ml)
Đáp án cần chọn là: C
Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam X gồm Fe, FeO, Fe2O3 và Fe3O4. Hoà tan m gam hỗn hợp X bằng HNO3 dư, thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị m là:
FexOy + (6x - 2y) HNO3 → xFe(NO3)3 + (3x - 2y) NO2 + (3x -y) H2O
0,13x−2ymol 0,1mol
áp dụng định luật bảo toàn nguyên tố sắt:
nFe=8,4 : 56=0,1.x và 3x−2y ⇒ x =6 và y = 7
Vậy công thức quy đổi là: Fe6O7 (M = 448) và nFe6O7=0,13.6−2.7=0,025mol
=> mX = 0,025 . 448 = 11,2g
Cho V lít dung dịch NaOH 1M vào dung dịch chứa 0,14 mol AlCl3, thu được m gam kết tủa. Mặt khác, cho 1,5V lít dung dịch NaOH 1M vào dung dịch chứa 0,14 mol AlCl3, thu được 0,75m gam kết tủa. Giá trị của V là
Giả sử thí nghiệm 1 Al3+ dư => nNaOH = 3nkết tủa (1)
Thí ngiệm 2 : có sự hòa tan kết tủa vì NaOH tăng mà lượng kết tủa giảm
=> nkết tủa = 4.nAlCl3 – nOH- (2)
Từ (1),(2) : V = 0,32 lit
Đáp án cần chọn là: A
Cho một lượng hỗn hợp X gồm K và Na vào 100 ml dung dịch Y gồm HCl 1,5M và CuCl2 1M. Sau phản ứng thu được 2,8 lít khí (đktc) và m gam kết tủa. Giá trị của m là
nHCl = 0,1.1,5 = 0,15 mol; nCuCl2 = 0,1.1 = 0,1 mol
nH2 = 0,125 mol
Na + H2O → NaOH + ½ H2
K + H2O → KOH + ½ H2
nOH- = 2nH2 = 0,125.2 = 0,25 mol
H+ + OH- → H2O
0,15 → 0,15
Cu2+ + 2OH- → Cu(OH)2
0,1 → 0,05 (mol)
=> mkết tủa = 0,05.98 = 4,9 gam
Đáp án cần chọn là: C
Dẫn từ từ đến dư khí CO2 vào dung dịch Ba(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào thể tích khí CO2 tham gia phản ứng (x lít, đktc) được biểu diễn bằng đồ thị sau:
.jpg)
Giá trị của m là
- Xét tại giá trị VCO2 = a (lít), tức là nCO2 = a/22,4 (mol) (thời điểm trước khi kết tủa cực đại)
Khi đó chỉ xảy ra phản ứng sau:
CO2 + Ba(OH)2 → BaCO3 + H2O
Ta thấy: nBaCO3 = nCO2 ⟹ 2m/197 = a/22,4 (1)
- Xét tại giá trị VCO2 = a + b (lít), tức là nCO2 = (a + b)/22,4 (mol) (thời điểm kết tủa cực đại)
Khi đó chỉ xảy ra phản ứng sau:
CO2 + Ba(OH)2 → BaCO3 + H2O
Ta thấy:
nOH- = 2.nBa(OH)2 = 2.nBaCO3 = 2.8m/197 = 16m/197 (mol)
- Xét tại VCO2 = a + 87,36 (lít), tức là nCO2 = (a + 87,36)/22,4 (mol) (kết tủa bị tan 1 phần)
Khi đó xảy ra 2 phản ứng:
CO2 + Ba(OH)2 → BaCO3 + H2O
CO2 + BaCO3 + H2O → Ba(HCO3)2
Khi đó nBaCO3 ↓ = nOH- - nCO2 ⟹ m/197 = 16m/197 - (a + 87,36)/22,4
⟹ 15m/197 = (a + 87,36)/22,4 (2)
Giải hệ (1), (2) ta có m = 59,1 và a = 13,44.
Vậy giá trị của m là 59,1.
Đáp án cần chọn là: C
Cho 5,6 g Fe tác dụng với 4,48 lít khí Cl2 (đktc). Khối lượng muối sắt thu được là?
2Fe + 3Cl2 → 2FeCl3
0,1 0,1
mmuối = 0,1.162,5 = 16,25 gam
Cho phản ứng: Fe + 2FeCl3 → 3FeCl2. Trong phản ứng này, chất bị khử là
Lưu ý đề hỏi chất bị khử (chất oxi hóa), Fe3+ đóng vai trò chất oxi hóa
Để phát hiện rượu (ancol etylic) trong hơi thở của các tài xế một cách nhanh và chính xác, cảnh sát dùng một dụng cụ phân tích có chứa bột X là oxit của crom và có màu đỏ thẫm. Khi X gặp hơi rượu sẽ bị khử thành hợp chất Y có màu lục thẫm. Công thức hóa học của X là Y lần lượt là
X là CrO3, Y là Cr2O3.
C2H5OH + 4CrO3 → 2Cr2O3 + 2CO2 + 3H2O
Cho các phát biểu sau:
(a) Trong bảng tuần hoàn các nguyên tố hóa học, crom thuộc chu kì 4, nhóm VIB.
(b) Các oxit của crom đều là oxit bazơ.
(c) Trong các hợp chất, số oxi hóa cao nhất của crom là +6.
(d) Trong các phản ứng hóa học, hợp chất crom(III) chỉ đóng vai trò chất oxi hóa.
(e) Khi phản ứng với khí Cl2 dư, crom tạo ra hợp chất crom(III).
Trong các phát biểu trên, những phát biểu đúng là:
phát biểu đúng là (a), (c) và (e) .
Hóa chất dùng để phân biệt 2 chất mất nhãn (NH4)2S và (NH4)2SO4?
Dùng Ba(OH)2
Có khí mùi khai là (NH4)2S
Có khí mùi khai và kết tủa trắng là (NH4)2SO4
(NH4)2S + Ba(OH)2 → BaS + 2NH3↑ + 2H2O
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3↑ + 2H2O
→ Đáp án B
Những chất phân biệt ba hợp kim: Cu-Ag, Cu-Al, Cu-Zn?
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch H2SO4 lần lượt vào các mẩu thử.
- Hợp kim nào không có khí là Cu-Ag.
- Cho dung dịch NH3 vào dung dịch thu được trong hai trường hợp còn lại.
+ Trường hợp tạo kết tủa keo trắng và không tan trong NH3 dư ⇒ hợp kim là Cu-Al.
3Al + 3H2SO4 → Al2(SO4)3 + 3H2
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
+ Trường hợp tạo kết tủa rồi tan trong NH3 dư ⇒ hợp kim ban đầu là Cu-Zn.
Zn + H2SO4 → ZnSO4 + H2
ZnSO4 + 2NH3 + 2H2O → Zn(OH)2 + (NH4)2SO4
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
Tính % theo khối lượng của FeCO3 trong quặng xi đe rit, người ta làm như sau: còn 0,6g mẫu quặng, chế hóa nó theo một quy trình hợp lí, thu được FeSO4 trong môi trường H2SO4 loãng. Chuẩn đọ dung dịch thu được bằng dung dịch chuẩn KMnO4 0,025M thì dùng vừa hết 25,2ml.
nKMnO4 = (0,025.25,2)/1000 = 6,3.10-4 mol
Phương trình phản ứng:
10FeSO4 (3,15.10-3) + 8H2SO4 + 2KMnO4 (6,3.10-4) → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
mFeCO3 = 3,15.10-3. 116 = 0,3654g
%FeCO3 = (0,3654/0,6). 100% = 60,9%
→ Đáp án C
Cho các chất: (1) C6H5NH2; (2) C2H5NH2; (3) (C6H5)2NH; (4) (C2H5)2NH; (5) NaOH; (6) NH3; Thứ tự sắp xếp các chất theo chiều tính bazơ giảm dần là:
Thứ tự sắp xếp các chất theo chiều tính bazơ giảm dần là: (5) > (4) > (2) > (6) > (1) > (3).
Cho dãy các chất: CH3NH2 (1), NH3 (2), C6H5NH2 (3), CH3NHCH3 (4), NaOH (5). Dãy các chất sắp xếp theo thứ tự lực bazơ giảm dần là
thứ tự lực bazơ giảm dần là (5), (4), (1), (2), (3).
Đốt 81,24 gam X gồm 0,07 mol peptit A (cấu tạo từ 2 aminoaxit trong số Gly, Ala, Val, Glu) và 2 este B, C mạch hở có cùng số liên lết pi trong phân tử ( MB > MC; B no, C đơn chức) cần 78,288 lít khí O2 thu được CO2, H2O và 3,136 lít N2. Mặt khác thủy phân X trên cần 570ml NaOH 2M, thu được T chứa 4 muối và 0,29 mol hỗn hợp 2 ancol no Y và Z ( MY = 2,875MX < 150). Dẫn toàn ancol này qua bình đựng Na dư thì thấy khối lượng bình tăng 23,49g. Biết các phản ứng xảy ra hoàn toàn, thể tích các khí đo ở đktc, T không chứa HCOONa. Phần trăm khối lượng của C gần nhất với giá trị nào bên dưới đây?
Từ điều kiện về phân tử khối của 2 ancol, ta tìm được Y là: C3H5(OH)3 ( a mol), Z là CH3OH (b mol)
Ta có: mbình tăng = mancol – mH2 = 92a + 32b – 1,5a.2 – 0,5b.2 = 89a + 32b = 23,49g
a + b = 0,29 mol
⇒ a = 0,25 mol; b = 0,04 mol
B no và 3 chức nên có 3 liên kết ℼ. Mà B, C có cùng số liên kết ℼ nên C đơn chức và có 2 liên kết ℼ C-C
mX = 16x + 18y + 14z = 81,24 – 0,25.86 – 0,04.40 – 1,14.44 – 0,28.15=3,78
nO2 = 2x + 1,5z = 3,495 – 0,25.9,5 – 0,04.4 – 0,25.0,28 = 0,89
Bảo toàn số mol peptit ta có: x + y = 0,07
⇒ x = 0,28; y = -0,21; c = 0,22
Ta có: 0,22 = 0,07.2 + 0,04.2 ⇒ C là: C4H5COOCH3
%mC = 0,04.112/81,24.1005 = 5,51%
⇒ Đáp án B

