Đề thi giữa HK2 môn Hóa học 12 năm 2021 - Trường THPT Bình Liêu
Đề thi giữa HK2 môn Hóa học 12 năm 2021 - Trường THPT Bình Liêu
-
Hocon247
-
40 câu hỏi
-
60 phút
-
187 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Nhỏ từ từ 200 ml dung dịch HCl vào 100 ml dung dịch X chứa Na2CO3, K2CO3, NaHCO3 (trong đó NaHCO3 có nồng độ 1M) thu được 1,12 lít CO2 (đktc) và dung dịch Y. Cho nước vôi trong dư vào dung dịch Y thu được 20 gam kết tủa. Nồng độ mol/l của dung dịch HCl là
nHCO3- ban đầu = nNaHCO3 = 0,1 mol.
nCO2 = 0,05 mol.
Đặt nH+ = nHCl = x mol và nCO3- ban đầu = y mol.
Do cho Ca(OH)2 vào dd Y thu được kết tủa nên dd Y chứa HCO3- còn dư.
Khi cho từ từ H+ vào dung dịch chứa hỗn hợp CO32- và HCO3- thì xảy ra phản ứng theo thứ tự:
H+ + CO32- → HCO3-
y ← y → y (mol)
H+ + HCO3- → H2O + CO2
0,05 ← 0,05 ← 0,05 (mol)
H+ hết ⟹ x = y + 0,05 (1)
Ta có: nHCO3- dư = 0,1 + y - 0,05 = y + 0,05 (mol)
BTNT C → nCaCO3 = nHCO3- dư → y + 0,05 = 0,2 → y = 0,15 (2)
Từ (1) và (2) → x = 0,2.
⟹ CM dd HCl = n : V = 0,2 : 0,2 = 1M.
Chọn A.
Cho hỗn hợp gồm 0,05 mol HCHO và 0,02 mol HCOOH vào lượng dư dung dịch AgNO3 trong NH3, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam Ag. Giá trị của m là
HCHO \(\xrightarrow{+AgN{{O}_{3}}/N{{H}_{3}}}\) 4Ag
HCOOH \(\xrightarrow{+AgN{{O}_{3}}/N{{H}_{3}}}\) 2Ag
⟹ nAg = 4nHCHO + 2nHCOOH = 4.0,05 + 2.0,02 = 0,24 mol.
⟹ m = 0,24.108 = 25,92 gam.
Chọn C.
Nhỏ từ từ đến dư dung dịch X gồm Ba(OH)2 1M và NaOH 2M vào dung dịch Y gồm a mol H2SO4 và b mol Al2(SO4)3. Sự phụ thuộc của tổng số mol kết tủa thu được vào thể tích dung dịch X nhỏ vào được biểu diễn theo đồ thị ở hình bên.
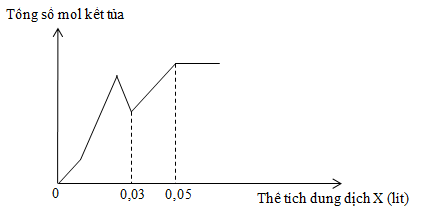
Tỉ lệ a : b là
Các phản ứng ion xảy ra:
H+ + OH- → H2O (1)
Al3+ + 3OH- → Al(OH)3 ↓ (2)
Al(OH)3 + OH- → AlO2- + 2H2O (3)
Ba2+ + SO42- → BaSO4 ↓ (4)
Lưu ý: Các phản ứng (1) (2) (3) xảy ra lần lượt, còn phản ứng (4) xảy ra độc lập.
Phân tích đồ thị:
+ Tại điểm gấp khúc đầu tiên thì H+ bị trung hòa hết.
+ Tại điểm gấp khúc thứ hai thì Al(OH)3 đạt cực đại.
+ Tại điểm gấp khúc thứ ba thì Al(OH)3 bị tan hết.
⟹ nOH- = nH+ + 4nAl3+ ⟹ 0,03.1.2 + 0,03.2 = 2a + 4.2b (1)
+ Tại điểm gấp khúc thứ tư thì BaSO4 cực đại.
⟹ nBa2+ = nSO42- ⟹ 0,05.1 = a + 3b (2)
Giải (1) và (2) được a = 0,02 và b = 0,01.
⟹ a : b = 2 : 1.
Chọn D.
Cho bốn hỗn hợp, mỗi hỗn hợp gồm hai chất rắn có số mol bằng nhau: Na2O và Al2O3; Cu và Fe2(SO4)3; BaCl2 và Na2SO4; Fe(NO3)2 và AgNO3. Số hỗn hợp có thể tan hoàn toàn trong nước (dư) chỉ tạo ra dung dịch là
- Hỗn hợp Na2O và Al2O3:
Na2O + H2O → 2NaOH
1 mol → 2 mol
Al2O3 + 2NaOH → 2NaAlO2 + H2O
1 mol 2 mol
⟹ Tan vừa hết.
- Hỗn hợp Cu và Fe2(SO4)3:
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
1 mol 1 mol
⟹ Tan vừa hết.
- Hỗn hợp BaCl2 và Na2SO4:
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
⟹ Tạo chất rắn BaSO4.
- Hỗn hợp Fe(NO3)2 và AgNO3:
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag ↓
⟹ Tạo chất rắn Ag.
Vậy có 2 hỗn hợp có thể tan hoàn toàn trong nước dư.
Chọn C.
Kết quả thí nghiệm của các chất hữu cơ X, Y, Z như sau:
- Loại B, D vì nếu Z là anilin thì không làm đổi màu quỳ tím.
- Loại A vì nếu A là saccarozo thì không tạo hợp chất màu tím với Cu(OH)2, to thường.
Chọn C.
Dẫn luồng khí CO đi qua hỗn hợp gồm CuO và Fe2O3 nung nóng, sau một thời gian thu được chất rắn X và khí Y. Cho Y hấp thụ hoàn toàn vào dung dịch Ba(OH)2 dư, thu được 29,55 gam kết tủa. Chất rắn X phản ứng với dung dịch HNO3 dư thu được V lít khí NO2 (sản phẩm khử duy nhất ở đktc). Giá trị của V là
\(\left\{ {\begin{array}{*{20}{l}}{CuO}\\{F{{\rm{e}}_2}{O_3}}\end{array}} \right.\mathop \to \limits^{ + CO} \left\{ {\begin{array}{*{20}{l}}{Chat{\mkern 1mu} ran{\mkern 1mu} X\mathop \to \limits^{ + HN{O_{3du}}} \left\{ {\begin{array}{*{20}{l}}{C{u^{2 + }}}\\{F{{\rm{e}}^{3 + }}}\\{N{O_3}^ - }\end{array}} \right. + N{O_2}}\\{C{O_2}}\end{array}} \right.\)
- Khi cho CO2 + Ba(OH)2 dư: nCO2 = nBaCO3 = 29,55/197 = 0,15 mol.
- Khi CO + oxit kim loại: nCO(pư) = nCO2 = 0,15 mol.
- Quan sát cả quá trình thì thấy chỉ có sự thay đổi số oxi hóa của C và N:
C+2 → C+4 + 2e
N+5 + 1e → N+4
Áp dụng bảo toàn e: 2nCO(pư) = nNO2 = 0,3 mol.
⟹ V = 0,3.22,4 = 6,72 lít.
Chọn B.
Đốt cháy hoàn toàn m gam một triglixerit X cần vừa đủ x mol O2, sau phản ứng thu được CO2 và y mol H2O. Biết m = 78x - 103y. Nếu cho a mol X tác dụng với dung dịch nước Br2 dư thì lượng Br2 phản ứng tối đa là 0,15 mol. Giá trị của a là
BTKL → mCO2 = mX + mO2 - mH2O = 110x - 121y (g) → nCO2 = 2,5x - 2,75y (mol)
Bảo toàn O → nO(trong X) = 2nCO2 + nH2O - 2nO2 = 3x - 4,5y (mol)
X có 6O → nX = 1/6.nO(trong X) = 0,5x - 0,75y (mol)
Khi đốt hợp chất hữu cơ chứa C, H, O thì:
\({n_{hchc}} = \frac{{{n_{C{O_2}}} - {n_{{H_2}O}}}}{{k - 1}}\) (với k là độ bất bão hòa của toàn phân tử)
\(\begin{array}{*{20}{l}}{ \to 0,5{\rm{x}} - 0,75y = \frac{{\left( {2,5{\rm{x}} - 2,75y} \right) - y}}{{k - 1}}}\\{ \to \left( {0,5{\rm{x}} - 0,75y} \right) = \frac{{5\left( {0,5{\rm{x}} - 0,75y} \right)}}{{k - 1}}}\\{ \to 1 = \frac{5}{{k - 1}}}\\{ \to k = 6}\end{array}\)
Suy ra X có chứa 6 liên kết π, mà có 3 π trong 3 nhóm COO → còn lại 3 π ngoài gốc hiđrocacbon
- Khi X phản ứng với Br2 thì X + 3Br2 → Sản phẩm cộng
→ nX = 1/3.nBr2 = 1/3.0,15 = 0,05 mol = a
Chọn D.
Hỗn hợp khí X chứa H2 và một hiđrocacbon Y mạch hở. Tỉ khối của X so với H2 là 4,6. Đun nóng nhẹ X có mặt xúc tác Ni thì nó biến thành hỗn hợp T không làm mất màu nước brom và có tỉ khối hơi so với H2 là 11,5. Công thức phân tử của hiđrocacbon Y là
BTKL: mX = mT ⟹ \(\frac{{{n_X}}}{{{n_T}}} = \frac{{{M_T}}}{{{M_X}}} = \frac{{11,5}}{{4,6}} = \frac{5}{2}\)
Giả sử nX = 5 mol và nT = 2 mol → ngiảm = nH2 (pư) = 5 - 2 = 3 mol.
CnH2n+2-2k + kH2 → CnH2n+2
3 → \(\frac{3}{k}\) (mol)
2 mol Y có chứa: \(\left\{ {\begin{array}{*{20}{l}}{{C_n}{H_{2n + 2}}:\frac{3}{k}}\\{{H_2}:2 - \frac{3}{k}}\end{array}} \right.\)
⟹ \({m_Y} = \frac{3}{k}.\left( {14n + 2} \right) + 2.\left( {2 - \frac{3}{k}} \right) = 2.2.11,5\)
⟹ n = k
⟹ Hiđrocacbon có CTPT là CnH2.
Quan sát các đáp án thì thấy C2H2 phù hợp.
Chọn A.
Dẫn từ từ đến dư khí CO2 vào dung dịch chứa 0,2 mol Ba(OH)2. Sự phụ thuộc của số mol kết tủa (a mol) vào số mol khí CO2 tham gia phản ứng (b mol) được biểu diễn như đồ thị sau:

Tỉ lệ y : x là
Giai đoạn 1: Đoạn đồ thị đi lên xảy ra phản ứng hình thành kết tủa:
CO2 + Ba(OH)2 → BaCO3 + H2O
→ nBaCO3 = nCO2 pư
Vậy tại A thì x = 0,075.
Giai đoạn 2: Đoạn đồ thị đi xuống xảy ra phản ứng hòa tan kết tủa:
BaCO3 + CO2 + H2O → Ba(HCO3)2
+ Tại điểm C(3t+0,025; 0,075) thì thu được:
BaCO3: 0,075
Ba(HCO3)2: 0,2 - 0,075 = 0,125 (bảo toàn Ba)
Bảo toàn C → nCO2 = nBaCO3 + 2nBa(HCO3)2 = 0,075 + 2.0,125 = 0,325 mol
⟹ 3t + 0,025 = 0,325
⟹ t = 0,1
+ Tại điểm B(y; 1,5t+0,025) = B(y; 0,175) thu được:
BaCO3: 0,175
Ba(HCO3)2: 0,2 - 0,175 = 0,025
Bảo toàn C → nCO2 = nBaCO3 + 2nBa(HCO3)2 = 0,175 + 2.0,025 = 0,225 mol
Vậy y = 0,225.
⟹ y : x = 0,225 : 0,075 = 3.
Chọn C.
Cho các phát biểu sau đây:
(a) Thành phần chính của bông nõn là xenlulozơ.
(b) Chất béo là đieste của glixerol và axit béo.
(c) Phân tử amilopectin có cấu trúc mạch phân nhánh.
(d) Ở nhiệt độ thường, triolein ở trạng thái rắn.
(e) Trong mật ong có chứa nhiều fructozơ.
(g) Tinh bột là một trong những lương thực cơ bản của con người.
Số phát biểu đúng là
(a) đúng.
(b) sai, chất béo là trieste của glixerol và axit béo.
(c) đúng.
(d) sai, triolein là chất béo không no nên có trạng thái lỏng ở nhiệt độ thường.
(e) đúng, mật ong chứa khoảng 40% fructozo.
(g) đúng.
Vậy có 4 phát biểu đúng.
Chọn C.
X là một hợp chất có công thức phân tử C6H10O5:
X + 2NaOH → 2Y + H2O;
Y + HCl loãng → Z + NaCl.
Hãy cho biết 0,1 mol Z tác dụng với Na dư thì thu được bao nhiêu lít khí H2?
Độ bất bão hòa của X là: \(k = \frac{{2C + 2 - H}}{2} = \frac{{2.6 + 2 - 10}}{2} = 2\)
X: HO-C2H4-COO-C2H4-COOH
Y: HO-C2H4-COONa
Z: HO-C2H4-COOH
HO-C2H4-COOH + 2Na → NaO-C2H4-COONa + H2
0,1 mol → 0,1 (mol)
⟹ VH2 = 0,1.22,4 = 2,24 lít.
Chọn B.
Cho 4,88 gam hỗn hợp Mg và Fe vào dung dịch gồm AgNO3 và Cu(NO3)2, thu được chất rắn X gồm ba kim loại và dung dịch Y gồm hai muối. Đun nóng X với dung dịch H2SO4 đặc, dư thu được 2,8 lít khí SO2 (đktc). Cho dung dịch NaOH dư vào Y, lọc lấy kết tủa rồi nung trong không khí, thu được 4,8 gam oxit. Giả thiết các phản ứng xảy ra hoàn toàn. Khối lượng của Fe trong X là:
Giả sử hỗn hợp đầu có: nMg = x và nFe = y (mol)
⟹ mhỗn hợp = 24x + 56y = 4,88 (1)
Đặt nFe dư = z (mol)
- Xét chất rắn sau nung:
Bảo toàn Mg ⟹ nMgO = nMg = x (mol)
Bảo toàn Fe ⟹ nFe2O3(oxit) = (nFe bđ - nFe dư)/2 = (y - z)/2 (mol)
⟹ moxit = 40x + 160.(y - z)/2 = 4,8 (2)
- Xét trạng thái đầu và cuối của các chất, sự thay đổi số oxi hóa là:
Mg0 → Mg+2 + 2e S+6 + 2e → S+4
Fe0 → Fe+3 + 3e O2 + 4e → 2O-2
(Chú ý: O2 là của phản ứng: 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3)
⟹ nO2 = ¼.nFe(OH)2 = ¼.(y - z) (mol)
Áp dụng bảo toàn e: 2nMg + 3nFe ban đầu = 2nSO2 + 4nO2
⟹ 2x + 3y = 2.0,125 + 4.0,25(y - z) (3)
Giải hệ (1) (2) (3) được x = 0,04; y = 0,07; z = 0,03
Khối lượng của Fe trong X là: mFe dư = 0,03.56 = 1,68 gam.
Chọn A.
Hòa tan hết 33,02 gam hỗn hợp gồm Na, Na2O, Ba và BaO vào nước dư thu được dung dịch X và 4,48 lít khí H2 (đktc). Cho dung dịch CuSO4 dư vào dung dịch X, thu được 73,3 gam kết tủa. Nếu sục 0,45 mol khí CO2 vào dung dịch X, sau khi kết thúc các phản ứng, thu được lượng kết tủa là
Quy đổi hỗn hợp thành: Na (a mol); Ba (b mol); O (c mol)
→ mhh = 23a + 137b + 16c = 33,02 (1)
Quá trình trao đổi e:
Na0 → Na+ + 1e O0 + 2e → O-2
Ba0 → Ba+2 + 2e 2H+ + 2e → H2
Áp dụng bảo toàn e: nNa + 2nBa = 2nO + 2nH2
→ a + 2b = 2c + 2.0,2 (2)
\(dd{\mkern 1mu} X\left\{ {\begin{array}{*{20}{l}}{N{a^ + }:a}\\{B{a^{2 + }}:b}\\{O{H^ - }:a + 2b}\end{array}} \right. + CuS{O_{4\left( {du} \right)}} \to \left\{ {\begin{array}{*{20}{l}}{Cu{{\left( {OH} \right)}_2}:\frac{{a + 2b}}{2} = 0,5{\rm{a}} + b}\\{BaS{O_4}:b}\end{array}} \right.\)
→ mkết tủa = 98.(0,5a + b) + 233b = 73,3 (3)
Giải hệ (1) (2) (3) được a = 0,28; b = 0,18; c = 0,12
\(C{O_2}:0,45 + X\left\{ {\begin{array}{*{20}{l}}{N{a^ + }:0,28}\\{B{a^{2 + }}:0,18}\\{O{H^ - }:0,64}\end{array}} \right. \to {m_ \downarrow } = ?\)
Ta thấy 1 < nOH- / nCO2 = 0,64 / 0,45 = 1,422 < 2
→ tạo CO32- (u mol) và HCO3- (v mol)
Giải hệ
\(\left\{ {\begin{array}{*{20}{l}}{{n_{C{O_2}}} = u + v = 0,45}\\{{n_{O{H^ - }}} = 2u + v = 0,64}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{u = 0,19}\\{v = 0,26}\end{array}} \right.\)
Ba2+ + CO32- → BaCO3 ↓
Bđ: 0,18 0,19
Pư: 0,18 → 0,18 → 0,18
→ m ↓ = mBaCO3 = 0,18.197 = 35,46 gam
Chọn D.
Cho sơ đồ các phản ứng theo đúng tỉ lệ mol:
(a) X → Y + CO2;
(b) Y + H2O → Z
(c) T + Z → R + X + H2O;
(d) 2T + Z → Q + X + 2H2O.
Các chất Q, R thỏa mãn sơ đồ trên lần lượt là
(a) CaCO3 \(\xrightarrow{{{t}^{o}}}\) CaO + CO2
(X) (Y)
(b) CaO + H2O → Ca(OH)2
(Y) (Z)
(c) NaHCO3 + Ca(OH)2 → NaOH + CaCO3↓ + H2O
(T) (Z) (R) (X)
(d) 2NaHCO3 + Ca(OH)2 → Na2CO3 + CaCO3↓ + 2H2O
(T) (Z) (Q) (X)
Vậy Q, R thỏa mãn là Na2CO3, NaOH.
Chọn C.
Cho 22,63 gam hỗn hợp (H) gồm hai chất hữu cơ X (C3H11N3O5) và Y (C4H9NO4, tạo bởi axit cacboxylic đa chức) đều mạch hở tác dụng vừa đủ với dung dịch NaOH, cô cạn dung dịch thu được 23,46 gam hỗn hợp muối Z; một ancol và một amin đều đơn chức. Mặt khác 0,3 mol (H) tác dụng với dung dịch KOH (dùng dư 15% so với lượng phản ứng), cô cạn dung dịch thu được m gam rắn khan. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Do tạo amin khí và ancol nên Y: CH3NH3OOC-COOCH3
⟹ X: CH3NH3OOC-CH2-NH3NO3
Đặt nX = x mol và nY = y mol
+) m(H) = 169x + 135y = 22,63 (1)
+) Khi cho 22,63 gam hỗn hợp tác dụng với NaOH:
Muối gồm: H2N-CH2-COONa (x mol); NaNO3 (x mol); NaOOC-COONa (y mol)
→ mmuối = 97x + 85x + 134y = 23,46 (2)
Giải (1) (2) được x = 0,07; y = 0,08
→ nhh (22,63g) = 0,07 + 0,08 = 0,15 mol
*Khi cho 0,3 mol (H) gồm 0,14 mol X và 0,08 mol Y tác dụng với KOH:
nKOH pư = 2nX + 2nY = 0,6 mol → nKOH dư = 0,6.15% = 0,09 mol
Chất rắn thu được gồm:
H2N-CH2-COOK (0,14 mol)
KNO3 (0,14 mol)
KOOC-COOK (0,16 mol)
KOH dư (0,09 mol)
→ mchất rắn = 61,56 gam
Chọn A.
Phát biểu nào sau đây là đúng?
Đáp án A: Sai vì một số kim loại có khối lượng riêng nhẹ hơn nước (Li, Na, K,...)
Đáp án C: Sai vì một số kim loại có nhiều số oxi hóa trong hợp chất (Fe, Cr, Cu,...)
Đáp án D: Sai vì ở điều kiện thường, Hg tồn tại ở thể lỏng
Đáp án B
M là kim loại trong số các kim loại sau: Cu Ba, Zn, Mg. Dung dịch muối MCl2 phản ứng với dung dịch Na2CO3 hoặc Na2SO4 tạo kết tủa, nhưng không tạo kết tủa khi phản ứng với dung dịch NaOH. Kim loại M là
Dung dịch muối MCl2 phản ứng với dung dịch Na2CO3 hoặc Na2SO4 tạo kết tủa, nhưng không tạo kết tủa khi phản ứng với dung dịch NaOH => Kim loại là Ba
BaCl2 + Na2CO3 → BaCO3 ↓ + 2NaCl
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
BaCl2 + NaOH không xảy ra
Đáp án C
Kim loại được dùng phổ biến để tạo trang sức, có tác dụng bảo vệ sức khỏe là
Kim loại dùng để tạo trang sức, có tác dụng bảo vệ sức khỏe là bạc
Đáp án B
Một cation kim loại M có cấu hình e ở lớp ngoài cùng là 2s22p6. Vậy cấu hình e ở lớp ngoài cùng của nguyên tử kim loại M là
Cấu hình electron của kim loại có thể có 1, 2 hoặc 3 electron lớp ngoài cùng
=> các trường hợp thỏa mãn là
1s22s22p63s1
1s22s22p63s2
1s22s22p63s23p1
Đáp án D
Hòa tan hoàn toàn 1,9 gam hỗn hợp gồm Fe, Mg và Al bằng dung dịch H2SO4 loãng vừa đủ, thu được 1,344 lít H2 (đktc). Khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng là
Sơ đồ: KL + H2SO4 → Muối + H2
Bảo toàn H → nH2SO4 = nH2 = 1,344/22,4 = 0,06 mol
Bảo toàn khối lượng → mmuối = mKL + mH2SO4 - mH2 = 1,9 + 0,06.98 - 0,06.2 = 7,66 gam
Đáp án A
Cho m (gam) hỗn hợp Al, Mg tác dụng với dung dịch HCl dư thu được 12,32 lít khí (đktc). Mặt khác, cũng m (gam) hỗn hợp trên cho tác dụng với dung dịch NaOH dư thu được 6,72 lít khí (đktc). Tính giá trị của m?
- Khi cho hỗn hợp trên tác dụng với NaOH dư thì chỉ có Al phản ứng:
Ta có: \({n_{{H_2}}} = \frac{{6,72}}{{22,4}} = 0,3\left( {mol} \right)\)
→ nAl = 0,2 mol => mAl = 0,2 * 27 = 5,4 (gam)
- Khi cho hỗn hợp trên tác dụng với HCl thì có Al và Mg đều phản ứng:
Ta có: \({n_{{H_2}}} = \frac{{12,32}}{{22,4}} = 0,55\left( {mol} \right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
0,25 ← 0,55 - 0,3 = 0,25 (mol)
→ mMg = 0,25. 24 = 6 (g)
Vậy m = mAl + mMg = 5,4 + 6 = 11,4 (g)
Đáp án D
Dung dịch Fe2(SO4)3 tác dụng với lượng dư kim loại nào tạo dung dịch chứa hai muối?
Đáp án A: Fe dư + Fe2(SO4)3 → FeSO4
Đáp án B: Zn dư + Fe2(SO4)3 → ZnSO4 + Fe
Đáp án C: Cu dư + Fe2(SO4)3 → FeSO4 + CuSO4
Đáp án D: Không phản ứng
Đáp án C
Thực nghiệm cho thấy Cu tác dụng được với dung dịch FeCl3 theo phương trình hoá học: Cu + 2 FeCl3 → 2FeCl2 + CuCl2. Như vậy,
Dựa vào quy tắc α:
Phản ứng giữa 2 cặp oxi hóa khử xảy ra theo chiều: chất oxi hóa mạnh tác dụng với chất khử mạnh tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn.
Ta có:
Cu + 2 Fe3+ → 2Fe2+ + Cu2+
C.KH mạnh C.OXH mạnh C.KH yếu C.OXH yếu
Vậy ion Fe3+ có tính oxi hoá mạnh hơn ion Cu2+
Đáp án D
Cho các phát biểu sau :
(1) Các kim loại kiềm đều tan tốt trong nước.
(2) Các kim loại Mg, Fe, K và Al chỉ điều chế được bằng phương pháp điện phân nóng chảy.
(3) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag.
(4) Khi cho Al vào dung dịch FeCl3 dư thu được kim loại Fe.
Số phát biểu đúng là
(1) đúng
(2) sai vì Fe có thể điều chế bằng điện phân dung dịch
(3) sai K không khử được Ag+ trong dung dịch vì
2K + 2H2O → 2KOH + H2
2OH- + 2Ag+ → Ag2O + H2O
(4) sai vì FeCl3 dư : Al + 3FeCl3 → AlCl3 + 3FeCl2
Đáp án D
Cho 4 kim loại Al, Fe, Mg, Cu và 4 dung dịch ZnSO4, AgNO3, CuCl2, Al2(SO4)3. Kim loại khử được cả 4 dung dịch muối đã cho là
Mg là kim loại mạnh hơn những kim loại trong muối → Mg khử được cả 4 dung dịch muối
Phương trình phản ứng
Mg + ZnSO4 → MgSO4 + Zn
Mg + 2AgNO3 → Mg(NO3)2 + 2Ag
Mg + CuCl2 → MgCl2 + Cu
3Mg + Al2(SO4)3 → 3MgSO4 + 2Al
Đáp án B
Phản ứng nào dưới đây không xảy ra
Vì tính khử của kim loại Fe mạnh hơn Ni → ta có phương trình :
Fe + Ni2+ → Fe2+ + Ni
Đáp án A
Trong pin điện hóa Cu-Ag tại điện cực đồng xảy ra quá trình:
Quá trình hoạt động của pin Cu-Ag :
Cu → Cu2+ + 2e (sự oxi hóa)
Ag+ + 1e → Ag (sự khử)
Đáp án D
Dãy nào dưới đây gồm các kim loại sắp xếp theo chiều tăng dần tính oxi hóa ?
Theo dãy điện hóa, sắp xếp tính oxi hóa tăng dần : Na+ < Al3+ < Mn2+ < Cu2+ < Fe3+
Đáp án B
Phát biểu nào sau đây là sai?
Đáp án D sai, do một số dung dịch có chứa ion không điện phân được trong dung dịch như: NaCl, K2SO4, MgCl2,... (ion kim loại đứng trước Zn trong dãy hoạt động hóa học) thì khi đó catot sẽ không xuất hiện kim loại mà là khí H2 (nước bị điện phân)
Đáp án D
Có các bán phản ứng sau:
(1) Cu2+(dd) + 2e → Cu(r)
(2) Cu(r) → Cu2+(dd) + 2e
(3) 2H2O + 2e → H2 + 2OH-(dd)
(4) 2H2O→ O2 + 4H+ + 4e
(5) 2Br-(dd) → Br2(dd) + 2e
(6) 2H+(dd) + 2e →H2
Những bán phản ứng xảy ra ở catot trong quá trình điện phân là
Những bán phản ứng xảy ra ở catot trong quá trình điện phân là điện phân cation và nước
(1) Cu2+(dd) + 2e →Cu(r)
(3) 2H2O + 2e → H2 + 2OH-(dd)
(6) 2H+(dd) + 2e →H2
Đáp án B
Cho dung dịch chứa các ion: Na+, Al3+, Cu2+, Cl-, SO42-, NO3- . Các ion không bị điện phân khi ở trạng thái dung dịch là:
Các ion không bị điện phân khi ở trạng thái dung dịch là: Na+, Al3+ , SO42-, NO3-
Đáp án A
Điện phân dung dịch gồm a mol CuSO4 và 2a mol NaCl sau khi ở catot bắt đầu thoát khí thì dừng lại. Chất tan trong dung dịch thu được sau điện phân là
(1) 2NaCl + CuSO4 → Cu +Cl2 + Na2SO4
Ở (1) NaCl phản ứng vừa đủ với CuSO4 => Dung dịch sau điện phân chỉ có Na2SO4
Đáp án C
Thí nghiệm nào sau đây chỉ xảy ra ăn mòn hóa học?
- A sai vì có phản ứng: Zn + CuSO4 → ZnSO4 + Cu
Cu sinh ra bám vào Zn và cùng tiếp xúc với dung dịch điện li nên xảy ra ăn mòn điện hóa.
- B đúng vì Fe và C tiếp xúc với nhau nhưng môi trường khí O2 không phải là môi trường chất điện li nên chỉ xảy ra ăn mòn hóa học.
- C sai vì có phản ứng: Fe + CuSO4 → FeSO4 + Cu
Cu sinh ra bám vào Fe và cùng tiếp xúc với dung dịch điện li nên xảy ra ăn mòn điện hóa.
- D sai vì Fe và C tiếp xúc trực tiếp và cùng được đặt trong môi trường chất điện li (không khí ẩm) nên xảy ra ăn mòn điện hóa.
Đáp án B
Để chống ăn mòn cho đường ống dẫn dầu bằng thép chôn dưới đất, người ta dùng phương pháp điện hoá. Trong thực tế, người ta dùng kim loại nào sau đây làm điện cực hi sinh ?
Thực tế người ta dùng Zn phải dùng kim loại hoạt động mạnh hơn để hi sinh bên ngoài, bảo vệ kim loại Fe bên trong
Đáp án A
Cho các thí nghiệm sau :
- TN1: Cho thanh Fe vào dung dịch FeCl3
- TN2: Cho thanh Fe vào dung dịch CuSO4
- TN3: Cho thanh Cu vào dung dịch FeCl3
- TN4: Cho thanh Fe tiếp xúc với thanh Cu rồi cho vào dung dịch HCl.
Số trường hợp xuất hiện ăn mòn điện hoá là
TN1 : Fe + 2FeCl3 → 3FeCl2
→ ăn mòn hóa học vì không hình thành 2 điện cực mới
TN2 : Fe + CuSO4 : ăn mòn điện hóa vì hình thành 2 điện cực Fe và Cu. Hai điện cực tiếp xúc với nhau và tiếp xúc với dung dịch điện li \(F{{e}^{2+}},\,\,C{{u}^{2+}}\)
TN3 : Cu + FeCl3 : ăn mòn hóa học vì không hình thành 2 điện cực mới
TN4: Ăn mòn điện hóa vì có 2 kim loại tiếp xúc với nhau và cùng tiếp xúc với dung dịch chất điện li. Fe là cực (-), Cu là cực (+)
Tại cực (-) : \(Fe\to F{{e}^{2+}}+2e\)
Tại cực (+) : \(2{{H}^{+}}+2e\to {{H}_{2}}\)
→ có 2 trường hợp xuất hiện ăn mòn điện hóa
Đáp án B
Dãy gồm các kim loại đều có thể điều chế được bằng phương pháp nhiệt luyện là
Phương pháp nhiệt luyện (dùng kim loại mạnh để đẩy kim loại yếu ra khỏi dung dịch muối) => dùng để điều chế các kim loại từ Mg trở về sau trong dãy điện hóa
A. thỏa mãn
B. loại Ba
C. Loại Na.
D. Loại Ca
Đáp án A
Hỗn hợp bột X gồm BaCO3, Fe(OH)2, Al(OH)3, CuO, MgCO3. Nung X trong không khí đến khối lượng không đối được hỗn hợp rắn A. Cho A vào nước dư khuấy đều được dung dịch B chứa 2 chất tan và phần không tan C. Cho khí CO dư qua bình chứa C nung nóng được hỗn hợp rắn E (Cho các phản ứng xảy ra hoàn toàn). E chứa tối đa:
\(\left\{ \begin{gathered} BaC{{\text{O}}_3} \hfill \\ Fe{(OH)_2} \hfill \\ Al{(OH)_3} \hfill \\ CuO \hfill \\ MgC{O_3} \hfill \\ \end{gathered} \right.\xrightarrow{{{t^o}}}\left\{ \begin{gathered} Ba{\text{O}} \hfill \\ F{e_2}{O_3} \hfill \\ A{l_2}{O_3} \hfill \\ CuO \hfill \\ MgO \hfill \\ \end{gathered} \right.\xrightarrow{{ + {H_2}O}}ddB\left\{ \begin{gathered} Ba{(OH)_2} \hfill \\ Ba{(Al{O_2})_2} \hfill \\ \end{gathered} \right. + \downarrow C\left\{ \begin{gathered} F{e_2}{O_3} \hfill \\ CuO \hfill \\ MgO \hfill \\ \end{gathered} \right.\xrightarrow{{ + CO}}E\left\{ \begin{gathered} Fe \hfill \\ Cu \hfill \\ MgO \hfill \\ \end{gathered} \right.\)
=> E chứa tối đa 2 đơn chất và 1 hợp chất
Đáp án D
Cho 29 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 950 ml dung dịch HNO3 1,5M, thu được dung dịch chứa m gam muối và 5,6 lít hỗn hợp khí X (đktc) gồm NO và N2O. Tỉ khối của X so với H2 là 16,4. Giá trị của m là
Đặt nNO = amol; nNO2 = b mol
=> a + b = 0,25 mol (1)
${{\bar{M}}_{X}}=\frac{30a+44b}{a+b}=16,4.2$ (2)
Từ (1) và (2) => a = 0,2 mol; b = 0,05 mol
Nếu sản phẩm khử chỉ có NO và N2O thì nHNO3 phản ứng = 4nNO + 10nN2O = 1,3 mol
Mà theo đầu bài nHNO3 phản ứng = 0,95.1,5 = 1,425 mol > 1,3 mol
=> trong dung dịch có sản phẩm khử là NH4NO3 (x mol)
=> nHNO3 phản ứng = 4nNO + 10nN2O + 10nNH4NO3 => 1,425 = 1,3 + 10x
=> x = 0,0125 mol
Bảo toàn e: nNO3 = ne cho = ne nhận = 3nNO + 8nN2O + 8nNH4NO3 = 1,1 mol
mmuối = mkim loại + mgốcNO3 + mNH4NO3 = 29 + 1,1.62 + 0,0125.80 = 98,2 gam
Đáp án A
Hòa tan hoàn toàn 11,90 gam hỗn hợp 3 kim loại X, Y, Z bằng dung dịch H2SO4 đặc, nóng thu được 7,616 lít khí SO2 (đktc), 0,640 gam S và dung dịch T. Cô cạn dung dịch T thu được m gam muối khan. Giá trị của m
nSO2 = 0,34 mol; nS = 0,02 mol
Ta có : ne nhận = ne cho = 0,34.2 + 0,02.6 = 0,8 mol
\({{n}_{SO_{4}^{2-}}}=\dfrac{{{n}_{e\,\,cho}}}{2}=\text{ }0,4\text{ }mol\)
=> mmuối = mkim loại + mSO4 = 11,9 + 0,4.96 = 50,3 gam
Đáp án A
Cho 51,75 gam bột kim loại M hóa trị II vào 200 ml dung dịch CuCl2 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được 51,55 gam hỗn hợp kim loại. Kim loại M là
nCuCl2 = 0,2.1 = 0,2 (mol)
Phản ứng xảy ra hoàn toàn, sau phản ứng thu được hỗn hợp kim loại nên Cu phản ứng hết, M phản ứng dư.
M + Cu2+ → M2+ + Cu↓
0,2 ←0,2 → 0,2 (mol)
Khối lượng kim loại giảm = mM pư - mCu sinh ra
=> 51,75 - 51,55 = 0,2.M - 0,2.64
=> M = 65 (Zn)
Đáp án C

