Đề thi giữa HK2 môn Hóa học 12 năm 2021-2022 - Trường THPT Ngô Gia Tự
Đề thi giữa HK2 môn Hóa học 12 năm 2021-2022 - Trường THPT Ngô Gia Tự
-
Hocon247
-
40 câu hỏi
-
60 phút
-
69 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Phương pháp nhiệt nhôm dùng để điều chế kim loại:
Phương pháp nhiệt nhôm dùng để điều chế kim loại đứng sau Al
Đáp án cần chọn là: B
Để làm sạch lớp cặn trong các dụng cụ đun và chứa nước nóng, người ta thường dùng:
Để làm sạch lớp cặn trong ống đun thường là CaCO3 người ta thường sử dụng giấm ăn
CaCO3 + 2 CH3COOH → (CH3COO)2Ca + H2O
Đáp án cần chọn là: B
Có thể dùng dung dịch nào sau đây để phản ứng hoàn toàn một mẫu gang ?
- Trong gang có C nên không hòa tan được trong các dung dịch HCl, H2SO4 loãng, NaOH.
- Để hòa tan hoàn toàn mẫu gang ta có thể dùng dung dịch HNO3 đặc, nóng.
Đáp án cần chọn là: D
Cho Br2 vào dung dịch CrCl3 trong môi trường NaOH thì sản phẩm thu được có chứa:
2CrCl3 + 3Br2 + 16NaOH → 2Na2CrO4 + 6NaBr + 6NaCl + 8H2O
Đáp án cần chọn là: C
Cho các tác hại sau:
1, Gây ngộ độc nước uống.
2, Có tính tẩy màu, ăn mòn da tay
3, Làm mất tính tẩy rửa của xà phòng, làm hư hại quần áo.
4, Làm hỏng các dung dịch pha chế. Làm thực phẩm lâu chín và giảm mùi vị thực phẩm.
5, Gây hao tốn nhiên liệu và không an toàn cho các nồi hơi, làm tắc các đường ống dẫn nước.
6, Sử dụng nước cứng để ăn uống dễ dẫn đến các bệnh lí như sỏi thận, sỏi mật.
Số tác hại mà nước cứng gây ra là
Nước cứng không gây ngộ độc nước uống và cũng không có tính tẩy màu, ăn mòn da tay.
Đáp án cần chọn là: B
Phương pháp thường được áp dụng để chống ăn mòn kim loại là
Các phương pháp bảo vệ kim loại không bị ăn mòn là:
+ Phương pháp bảo vệ bề mặt.
+ Phương pháp điện hóa.
Đáp án cần chọn là: A
Cho từ từ đến dư kim loại Na vào dung dịch có chứa muối FeCl3. Sau phản ứng thu được kết tủa Y và dung dịch X chứa
2Na + 2H2O → 2NaOH + H2
FeCl3 + 3NaOH → Fe(OH)3 + 3 NaCl
=> Kết tủa Y là Fe(OH)3 . Dung dịch X gồm NaCl và NaOH dư
Đáp án cần chọn là: B
Nhận xét nào sau đây là không đúng ?
Nhận xét không đúng là : Be, Mg, Ca, Sr, Ba đều phản ứng với nước ở nhiệt độ thường nên gọi là kim loại kiềm thổ.
Vì Be không phản ứng với nước, còn Mg phản ứng với nước ở nhiệt độ cao.
Đáp án cần chọn là: D
Trong không khí ẩm, kim loại đồng bị bao phủ bởi lớp màng
Trong không khí ẩm, kim loại đồng bị bao phủ bởi lớp màng CuCO3.Cu(OH)2 (màu xanh).
Đáp án cần chọn là: D
Tính chất vật lí nào sau đây của sắt khác với các đơn chất kim loại khác ?
Tính chất khác là sắt có tính nhiễm từ
Đáp án cần chọn là: D
Vì sao những vật bằng nhôm hàng ngày tiếp xúc với nước dù ở nhiệt độ nào cũng không xảy ra phản ứng ?
Những vật bằng nhôm hàng ngày tiếp xúc với nước dù ở nhiệt độ nào cũng không xảy ra phản ứng vì trên bề mặt vật được phủ một lớp nhôm oxit mỏng, bền, ngăn cách vật với nước.
Đáp án cần chọn là: B
Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3, khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (gồm hai muối) và chất rắn Y (gồm một kim loại). Hai muối trong X là
Chất rắn Y gồm một kim loại có tính khử yếu nhất là: Ag
Dung dịch X gồm hai muối của kim loại có tính khử mạnh nhất => Phản ứng vừa đủ hai kim loại hết
→ TH1: Hai muối trong X là Mg(NO3)2 và Fe(NO3)2.
Mg + 2Ag+ → Mg2+ + 2Ag↓
Fe + 2Ag+ → Fe2+ + 2Ag ↓
→ TH2: Hai muối trong X là Mg(NO3)2 và Fe(NO3)3.
Mg + 2Ag+ → Mg2+ + 2Ag↓
Fe + 2Ag+ → Fe2+ + 2Ag ↓
Fe2+ + Ag+ → Fe3+ + 2Ag ↓
Đáp án cần chọn là: D
Khi điện phân dung dịch CuCl2, ở catot xảy ra
Khi điện phân dung dịch CuCl2, ở catot xảy ra : Cu+2 + 2e → Cu
→ xảy ra sự khử ion Cu2+
Đáp án cần chọn là: A
Kim loại nào sau đây không phải kim loại kiềm
Ca là kim loại kiềm thổ
Đáp án cần chọn là: A
Trong các oxit sau : CuO; Al2O3; SO2. Hãy cho biết chất nào chỉ phản ứng được với bazơ và chất nào phản ứng được cả với axit và bazơ ?
- Chất chỉ phản ứng được với bazơ là SO2.
- Chất chỉ phản ứng được với cả axit và bazơ là Al2O3
Đáp án cần chọn là: C
Trong quá trình hoạt động của pin điện hoá Fe-Cu nồng độ của các ion trong dung dịch biến đổi như thế nào ?
Quá trình hoạt động của pin Fe-Cu :
Fe → Fe2+ + 2e => tăng nồng độ ion Fe2+
Cu2+ + 2e → Cu => giảm nồng độ ion Cu2+
Đáp án cần chọn là: C
Cho dãy: R → RCl2 → R(OH)2 → R(OH)3 → Na[R(OH)4].
R có thể là kim loại nào sau đây?
Nhận thấy kim loại R có 2 hóa trị II và III => loại A và D
hiđroxit R(OH)3 tác dụng với dung dịch kiềm tạo Na[R(OH)4] => R là Cr
Đáp án cần chọn là: B
Trong ăn mòn điện hóa, cực âm xảy ra
Quá trình ăn mòn điện hóa là quá trình oxi hóa – khử, trong đó kim loại ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương → sự oxi hóa ở cực âm và sự khử ở cực dương.
=> Kim loại ở cực âm bị tan ra.
Đáp án cần chọn là: A
X là kim loại thuộc nhóm IIA. Cho 1,7 gam hỗn hợp gồm kim loại X và Zn tác dụng với lượng dư dung dịch HCl, sinh ra 0,672 lít khí H2 (ở đktc). Mặt khác, khi cho 1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng, thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc). Kim loại X là
Gọi M là kí hiệu chung của 2 kim loại X và Zn
a là số mol của M
M + 2HCl → MCl2 + H2
=> nH2 = 0,03 mol = a
→ \( \to {{\bar M}_M} = \frac{{1,7}}{{0,03}} = 56,67\)
Vì MZn = 65 > 56,67 => MX < 56,67
X + H2SO4 → XSO4 + H2
→ \( \to {n_X} = \frac{{1,9}}{{{M_X}}} = {n_{{H_2}}}{\rm{\;}}{\mkern 1mu} \to {\mkern 1mu} {\mkern 1mu} \frac{{1,9}}{{{M_X}}} < 0,05\)
=> MX > 38
Ta có: 38 < MX < 56,67 => kim loại X là Ca
Đáp án cần chọn là: B
Hoà tan a gam Cu và Fe (Fe chiếm 40% về khối lượng) bằng 30 ml dung dịch HNO3 60% (D = 1,4 g/ml). Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn X cân nặng 0,65a gam, dung dịch Y và 3,36 lít hỗn hợp khí NO và NO2 (đktc). Cô cạn Y thì số gam muối thu được là
mFe = 0,4a gam; mCu = 0,6a gam;
vì mchất rắn không tan< mCu ban đầu => Fe còn dư và Cu chưa phản ứng
=> dung dịch Y chỉ chứa muối Fe(II)
Gọi nNO = x mol; nNO2 = y mol
=>x + y = 0,15 (1)
mddHNO3 = 1,4.30 = 42 gam => mHNO3 = 42 . 60% = 25,2 gam => nHNO3 = 0,4 mol
Ta có nHNO3 = 4nNO + 2nNO2 => 4x + 2y = 0,4 (2)
Từ (1) và (2) =>x = 0,05 và y = 0,1
=> ne cho = 2.nFe(NO3)2= ne nhận = 3nNO + nNO2 = 3.0,05 + 0,1 = 0,25 mol
=> nFe(NO3)2 = 0,125 mol => m = 22,5gam
Đáp án cần chọn là: B
Cho 4 kim loại Al, Fe, Mg, Cu và 4 dung dịch ZnSO4, AgNO3, CuCl2, Al2(SO4)3. Kim loại khử được cả 4 dung dịch muối đã cho là
Mg là kim loại mạnh hơn những kim loại trong muối → Mg khử được cả 4 dung dịch muối
Phương trình phản ứng
Mg + ZnSO4 → MgSO4 + Zn
Mg + 2AgNO3 → Mg(NO3)2 + 2Ag
Mg + CuCl2 → MgCl2 + Cu
3Mg + Al2(SO4)3 → 3MgSO4 + 2Al
Đáp án cần chọn là: B
Điện phân dung dịch CuSO4 nồng độ 0,5M với điện cực trơ trong thì thu được 1 gam Cu. Nếu dùng dòng điện một chiều có cường độ 1A, thì thời gian điện phân tối thiểu có giá trị gần nhất là
Áp dụng công thức Faraday để tính khối lượng chất thoát ra ở điện cực.
Khối lượng Cu thoát ra ở điện cực bằng:
\({m_{Cu}} = \frac{{A.I.t}}{{n.F}} \to t = \frac{{{m_{Cu}}.n.F}}{{A.I}} = \frac{{1 \times 96500 \times 2}}{{64 \times 1}} = 3015,625\left( s \right)\) = 50 phút 15 giây
Đáp án cần chọn là: A
Điện phân với các điện cực trơ dung dịch hồn hợp gồm 0,2 mol CuSO4 và 0,12 mol HCl trong thời gian 2000 giây với dòng điện có cường độ là 9,65A (hiệu suất của quá trình điện phân là 100%). Khối lượng Cu thoát ra ở catot và thể tích khí (đktc) thoát ra ở anot là
\({n_e} = \frac{{2000.9,65}}{{96500}} = 0,2(mol)\)
Do trong dung dịch điện phân có Ion Cl- nên tại cực dương giai đoạn đầu Cl- bị oxy hóa.
Anot:
2Cl- → Cl2 + 2e
0,12 0,06 0,12 < 0,2
=> H2O đã bị điện phân
2H2O → O2 + 4e + 4H+
0,02 0,08
=> V = (0,06 + 0,02).22,4 = 1,792 (lit)
Catot:
Cu2+ + 2e → Cu
0,2 0,4 > 0,2
=> Cu2+ điện phân một phần
=> nCu = 0,2/2 = 0,1 (mol)
=> mCu = 0,1.64 = 6,4 (gam)
Đáp án cần chọn là: C
Điện phân dung dịch gồm a mol CuSO4 và 2a mol NaCl sau khi ở catot bắt đầu thoát khí thì dừng lại. Chất tan trong dung dịch thu được sau điện phân là
(1) 2NaCl + CuSO4 → Cu +Cl2 + Na2SO4
Ở (1) NaCl phản ứng vừa đủ với CuSO4 => Dung dịch sau điện phân chỉ có Na2SO4
Đáp án cần chọn là: C
Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
Khí CO chỉ khử được CuO
Áp dụng tăng giảm khối lượng: mchất rắn giảm = mO (oxit bị khử) = 9,1 – 8,3 = 0,8 gam
=> nCuO = nO (oxit bị khử) = 0,8 / 16 = 0,05 mol
=> mCuO = 4 gam
Đáp án cần chọn là: D
Cho 1,82 g một kim loại kiềm tác dụng hết với 48,44 gam nước, sau phản ứng thu được 2,912 lít khí H2 (đktc) và dung dịch X. Kim loại kiềm và nồng độ phần trăm dung dịch X là
nH2 = 2,912:22,4 = 0,13 mol
2A + 2H2O → 2AOH + H2
0,26 ← 0,26 ← 0,13 (mol)
=> MA = 1,82 : 0,26 = 7 (Li)
mLiOH = 0,26.24 = 6,24 (g)
BTKL: m dd sau pư = mKL + mH2O – mH2 = 1,82 + 48,44 – 0,13.2 = 50 (g)
C%LiOH = 6,24.100%/50 = 12,48%
Đáp án cần chọn là: C
Hòa tan 5,9 gam hỗn hợp X gồm K và Ca vào nước dư, sau phản ứng thu được 2,24 lít khí H2. Khối lượng Ca có trong hỗn hợp X là
Gọi nK = x mol; nCa = y mol => mhỗn hợp = 39x + 40y = 5,9 (1)
Bảo toàn electron: nK + 2nCa = 2nH2 => x + 2y = 0,1.2 (2)
Từ (1), (2) => x = 0,1; y = 0,05
=> mca = 2 gam
Đáp án cần chọn là: B
Sục khí CO2 từ từ cho đến dư vào 200 ml dung dịch hỗn hợp NaOH 2M và Ca(OH)2 1M thu được dung dịch A. Cô cạn dung dịch A rồi nhiệt phân đến khối lượng không đổi thu được m gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
CO2 đến dư thì dung dịch gồm 0,4 mol NaHCO3 và 0,2 mol Ca(HCO3)2
Khi nhiệt phân hoàn toàn thu được : 0,2 mol Na2CO3 và 0,2 mol CaO
=> m = 32,4 gam
Đáp án cần chọn là: B
Thổi từ từ khí CO2 đến dư vào dung dịch chứa 0,12 mol Ca(OH)2 . Sự phụ thuộc của số mol kết tủa thu được vào số mol CO2 phản ứng được biểu điễn theo đồ thị sau:
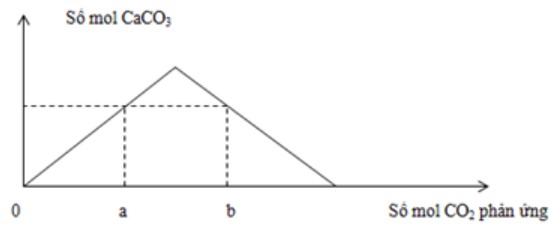
Mối quan hệ của a và b là:
Các phản ứng:
Ca(OH)2 + CO2 → CaCO3 + H2O(1)
CaCO3 + CO2 + H2O → Ca(HCO3)2(2)
- Tại nCO2 = a (đồ thị đi lên) => Chỉ xảy ra phản ứng (1)
=> nCaCO3 = nCO2 = a
- Tại nCO2 = b (đồ thị đi xuống): Kết tủa đã bị hòa tan một phần
Sản phẩm lúc này gồm:
CaCO3: a mol
Ca(HCO3)2: 0,12 - a (BTNT "Ca")
BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2 => b = a + 2(0,12 - a)
=> b = 0,24 - a
Đáp án cần chọn là: A
Cho 0,85 lít dung dịch NaOH 1M vào dung dịch chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn, thu được m gam kết tủa. Giá trị của m là:
Ta có: nOH- = nNaOH = 0,85 mol; nAl3+ = 2.nAl2(SO4)3 = 0,2 mol; nH+ = 2.nH2SO4 = 0,2 mol
Thứ tự phản ứng khi cho OH- vào {H+; Al3+} là:
(1) H+ + OH- → H2O
0,2 0,2 mol
Lượng OH- còn lại sau phản ứng (1): \({n_{O{H^ - }con\,lai}} = {n_{O{H^ - }}} - {n_{{H^ + }}} = 0,85 - 0,2 = 0,65(mol)\)
Xét tỉ lệ (*) = 0,65 : 0,2 = 3,25 → 3< (*) < 4 → Kết tủa tan 1 phần; (1) (2) đã kết thúc, (3) đang xảy ra
Áp dụng công thức tính nhanh (xem cách chứng minh ở mục phương pháp):
nOH- = nH+ + 4nAl3+ - nAl(OH)3
→ 0,85 = 0,2 + 4.0,2 - nAl(OH)3
→ nAl(OH)3 = 0,15 mol
→ mkết tủa = 0,15.78 = 11,7 (g)
Đáp án cần chọn là: A
Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch Al2(SO4)3 hiện tượng quan sát được là
PTHH: Ba(OH)2 + Al2(SO4)3 → BaSO4↓ + Al(OH)3↓
Ba(OH)2 + Al(OH)3 → Ba(AlO2)2 + H2O
Vậy hiện tượng quan sát được là xuất hiện kết tủa trắng (gồm BaSO4↓ và Al(OH)3↓) sau đó tan một phần Al(OH)3.
Đáp án cần chọn là: D
Nung hỗn hợp A gồm 22,8 gam Cr2O3 và m gam Al. Sau khi phản ứng hoàn toàn thu được 33,6 gam hỗn hợp rắn X. Cho toàn bộ X phản ứng với axit HCl dư thoát ra V lít H2 (đktc). Giá trị của V là:
nCr2O3 = 0,15 mol
Bảo toàn khối lượng : mCr2O3 + mAl = mhỗn hợp X => mAl = 33,6 – 22,8 = 10,8 gam
→ nAl = 0,4 mol
Cr2O3 + 2Al ⟶ Al2O3 + 2Cr
0,15 → 0,3 → 0,3
→ nAl dư = 0,4 – 0,3 = 0,1 mol
Bảo toàn e : 2nH2 =2nCr + 3nAl dư => V = 0,45.22,4 = 10,08 lít
Đáp án cần chọn là: A
Nhận biết lọ đựng Fe và Fe2O3 bằng phương pháp hóa học trong 3 lọ hóa chất đựng hỗn hợp các chất rắn sau Fe và FeO; Fe và Fe2O3; FeO và Fe2O3 chỉ cần dùng loại thuốc thử nào dưới đây
Fe và Fe2O3 tan 1 phần trong HNO3 đặc nguội không có khí, 2 cái còn lại có khí
Fe và Fe2O3 khi cho vào HCl hay H2SO4 loãng cho dung dịch màu vàng nâu, có khí; Fe và FeO cho dung dịch màu lục nhạt (gần như trong suốt và có khí); FeO và Fe2O3 cho dung dịch màu vàng nâu và không có khí.
Vậy nên có thể dùng cả 3 dung dịch này để phân biệt 3 nhóm hỗn hợp 2 chất trên.
Đáp án cần chọn là: D
Nhiệt phân hoàn toàn 34,65 gam hỗn hợp gồm KNO3 và Cu(NO3)2, thu được hỗn hợp khí X có tỉ khối so với khí hiđro bằng 18,8. Khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
2KNO3 → 2KNO2 + O2
x → 0,5x
2Cu(NO3)2 → 2CuO + 4NO2 + O2
y → 2y → 0,5y
Ta có hệ phương trình:
\(\left\{ \begin{array}{l}
101x + 188y = 34,65\\
\frac{{(0,5x + 0,5y).32 + 2y.46}}{{0,5x + 0,5y + 2y}}
\end{array} \right. = 18,8.2 \to \left\{ \begin{array}{l}
x = 0,25\\
y = 0,05
\end{array} \right.\)
=> mCu(NO3)2 = 0,05.188 = 9,4 gam
Đáp án cần chọn là: A
Thổi khí NH3 dư đi qua 10 gam CrO3 đun nóng đến phản ứng hoàn toàn thu được chất rắn màu xanh lục có khối lượng là
nCrO3 = 0,1 (mol)
2NH3 + 2CrO3 → Cr2O3 + N2 + 3H2O
0,1 0,1 0,05
mCr2O3 = 0,05.152 = 7,6 (gam)
Đáp án cần chọn là: C
Hỗn hợp X gồm Na, Ba và Al2O3 (trong đó oxi chiếm 24,78% khối lượng). Hòa tan hết 29,05 gam X trong nước dư, thu được dung dịch Y và 4,48 lít H2 (đktc). Cho từ từ dung dịch Z chứa hỗn hợp HCl 0,8M và H2SO4 0,1M vào X đến khi thu được lượng kết tủa lớn nhất, lọc kết tủa và nung đến khối lượng không đổi, thu được m gam chất rắn. Giá trị gần nhất của m là
mO(X) = 29,05.24,78% = 7,2 gam => nO(X) = 0,45 mol
BTNT "O": nAl2O3 = nO(X) : 3 = 0,15 mol
Đặt nNa = x và nBa = y (mol)
mX = 23x + 137y + 0,15.102 = 29,05
BTe: nNa + 2nBa = 2nH2 => x + 2y = 2.0,2
Giải hệ thu được x = 0,3 và y = 0,05
Vậy dung dịch Y chứa: Na+ (0,3 mol), Ba2+ (0,05 mol), AlO2- (0,3 mol) và OH-
BTĐT tính được nOH- dư = nNa+ + 2nBa2+ - nAlO2- = 0,1 mol
Cho từ từ hỗn hợp HCl (8a mol) và H2SO4 (a mol) vào dd Y:
(1) H+ + OH- → H2O
(2) H+ + AlO2- + H2O → Al(OH)3
(3) 3H+ + Al(OH)3 → Al3+ + 3H2O
(4) Ba2+ + SO42- → BaSO4
nH+ = nHCl + 2nH2SO4 = 10a (mol); nSO42- = a mol
Các điểm cực đại của kết tủa:
- Điểm Al(OH)3 đạt cực đại: nH+ = nOH- + nAlO2- => 10a = 0,1 + 0,3 = 0,4 => a = 0,04
=> m1= mAl(OH)3 + mBaSO4 = 0,3.78 + 0,04.233 = 32,72 gam
- Điểm BaSO4 đạt cực đại: nBaSO4 = nSO42- = nBa2+ => a = 0,05 mol => nH+ = 0,5 mol
(1) H+ + OH- → H2O
0,1 ← 0,1
(2) H+ + AlO2- + H2O → Al(OH)3
0,3 ← 0,3 → 0,3
(3) 3H+ + Al(OH)3 → Al3+ + 3H2O
0,5-0,1-0,3 → 0,1/3
=> m2 = mAl(OH)3 + mBaSO4 = (0,3-0,1/3).78 + 0,05.233 = 32,45 gam
m1 > m2 => m1 = m kết tủa max
Vậy
\(\left\{ \begin{array}{l}
Al{(OH)_3}:0,3\\
BaS{O_4}:0,04
\end{array} \right. \to \left\{ \begin{array}{l}
A{l_2}{O_3}:0,15\\
BaS{O_4}:0,04
\end{array} \right.\)
=> m chất rắn = 0,15.102 + 0,04.233 = 24,62 gam
Đáp án cần chọn là: C
Hòa tan hoàn toàn a gam hỗn hợp gồm x mol AgNO3 và y mol Cu(NO3)2 vào nước, thu được dung dịch X. Cho một lượng Cu dư vào X thu được dd Y có chứa b gam muối. Cho một lượng Fe dư vào Y, thu được dung dịch Z có chứa c gam muối. Biết các phản ứng xảy ra hoàn toàn 2b = a + c. Tỉ lệ x : y là:
AgNO3 : x (mol)
Cu(NO3)2 : y (mol)
Dd Y : Cu(NO3)2 : 0,5x + y (mol)
Dd Z : Fe(NO3)2 : 0,5x + y (mol)
Vì sự chênh lệch khối lượng muối là do kim loại Cu thay thế Ag; Fe thay thế Cu còn NO3- bảo toàn nên :
2b = a + c
=>2.(0,5. x + y). 64 = 108x + 64y + (0,5x + y).56
=> 72x = 8y
=> 9x = y => x : y = 1: 9
Đáp án cần chọn là: D
Hòa tan hết m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước, thu được 0,06 mol khí H2 và dung dịch X. Hấp thụ hết 0,128 mol khí CO2 vào dung dịch X, thu được dung dịch Y (chỉ chứa các muối) và kết tủa Z. Chia dung dịch Y làm 2 phần bằng nhau:
+ Cho từ từ phần 1 vào 200 ml dung dịch HCl 0,24M thấy thoát ra 0,03 mol khí CO2.
+ Nếu cho từ từ 200 ml dung dịch HCl 0,24M vào phần 2 thấy thoát ra 0,024 mol khí CO2. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
Do lượng CO2 thu được ở 2 thí nghiệm khác nhau mặc dù lượng HCl như nhau nên X chứa CO32-, HCO3- và Na+
+ Phần 1: Cho từ từ CO32-, HCO3- vào H+ thì phản ứng xảy ra đồng thời theo đúng tỉ lệ về số mol (vì ban đầu H+ rất dư)
CO32- + 2H+ → H2O + CO2
x ← 2x → x
HCO3- + H+ → H2O + CO2
y ← y → y
=> nCO2 = x + y = 0,03 mol; nH+ = 2x + y = 0,24.0,2
Giải hệ thu được x = 0,018 và y = 0,012
=> nCO32- : nHCO3- = 0,018 : 0,012 = 3 : 2
+ Phần 2: Đặt nCO32- = 3a (mol) và nHCO3- = 2a (mol)
Cho từ từ H+ vào hỗn hợp CO32- và HCO3- thì phản ứng xảy ra theo thứ tự:
CO32- + H+ → HCO3-
3a → 3a → 3a
HCO3- + H+ → CO2 + H2O
0,024 ← 0,024
=> nH+ = 3a + 0,024 = 0,048 => a = 0,008
Vậy 1/2 dung dịch Y gồm: CO32- (0,024 mol), HCO3- (0,016 mol)
=> dd Y gồm: CO32- (0,048 mol), HCO3- (0,032 mol) và Na+ (0,128 mol) (theo BTĐT)
BTNT "C": nCO2 = nCO32-(Y) + nHCO3- (Y) + nBaCO3 => 0,128 = 0,048 + 0,032 + nBaCO3
=> nBaCO3 = 0,048 mol => nBa (hh) = nBaCO3 = 0,048 mol
nNa(hh) = nNa+ = 0,128 mol
BT electron: nNa + 2nBa = 2nO + 2nH2 => 0,128 + 2.0,048 = 2nO + 2.0,06 => nO = 0,052
=> m = mNa + mBa + mO = 0,128.23 + 0,048.137 + 0,052.16 = 10,352 gam
Đáp án cần chọn là: C
Điện phân dung dịch AgNO3 với điện cực trơ, sau một thời gian thu được dung dịch X chứa 2 chất tan có cùng nồng độ (mol/lít), và thấy khối lượng dung dịch giảm đi 11,6 gam so với ban đầu. Cho tiếp 3,36 gam bột Fe vào dung dịch X, thu được dung dịch Y và chất rắn Z và khí NO ( sản phẩm khử duy nhất của N5+). Biết các phản ứng xảy ra hoàn toàn. Tổng khối lượng muối trong dung dịch Y là:
PTHH: 4AgNO3 + 2H2O → 4Ag ↓ + O2 ↑ + 4HNO3
x → x → 0,25x → x
Gọi nAgNO3 bị điện phân là x (mol)
Ta có: mdd giảm = mAg + mO2
=> 108x + 0,25x. 32 = 11,6
=> x = 0,1 (mol)
Theo đề bài dd X là AgNO3 và HNO3 có nồng độ mol/l bằng nhau => nAgNO3 dư = nHNO3 = 0,1 (mol)
Fe + 4H+ + NO3- → Fe3+ + NO + 2H2O (1)
PƯ 0,025 ←0,1→0,025→ 0,025
Dư 0,035 0,14
Fe + 2Ag+ → Fe2+ + 2Ag↓ (2)
Pư 0,035 → 0,07→ 0,035
Dư 0,03
Ag+ + Fe2+ → Fe3+ + Ag↓ (3)
Pư 0,03 → 0,03→ 0,03
Sau phản ứng (1), (2) (3) => nFe2+ = nFe2+ (2) – nFe2+ (3) = 0,035- 0,03 = 0,005(mol)
nFe3+ = nFe3+ (1) + nFe3+ (3) = 0,025 + 0,03 = 0,055 (mol)
Vậy dd Y gồm : Fe(NO3)2: 0,005 mol; Fe(NO3)3: 0,055 (mol)
=> m= 0,005. 180 + 0,055. 242 = 14,21 (g)
Đáp án cần chọn là: B
Hòa tan hoàn toàn 3,92 gam bột Fe vào 44,1 gam dung dịch HNO3 50% thu được dung dịch X(không có ion NH4+, bỏ qua sự hòa tan của các khí trong nước và sự bay hơi của nước). Cho X phản ứng với 200ml dung dịch chứa đồng thời KOH 0,5M và NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y thu được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 20,56 gam hỗn hợp chất rắn khan. Nồng độ phần trăm của Fe(NO3)2 trong dung dịch X là
0,07 mol Fe + 0,35 mol HNO3 → DD X
X + 0,1 mol KOH + 0,2 mol NaOH → muối Z
Muối Z có K+ : 0,1 mol; Na+ : 0,2 mol; NO3- : x mol và OH- : y mol
Bảo toàn điện tích có x + y = 0,3 mol
Khi nhiệt phân Z thì NO3- → NO2- →mmuối = 39.0,1 + 23.0,2 + 46x + 17y = 20,56
→ x = 0,24 mol và y = 0,06 mol
→ dung dịch X cũng có 0,24 mol NO3- > 3nFe = 0,21 mol → dung dịch X chứa HNO3 và 0,07 mol Fe(NO3)3
Bảo toàn N có nHNO3(X) = 0,24 – 0,07.3 =0,03 mol
Đặt sản phẩm khử của phản ứng là N+n thì ta có
N+5 + (5-n) e → N+n
Fe → Fe+3 + 3e
Ta có \({n_{{N^{ + n}}}} = {n_{HN{O_3}(bd)}} - {n_{N{O_3}(X)}} = 0,35 - 0,24 = 0,11\{ Al(OH)3:0,3BaSO4:0,04Nung\{ Al2O3:0,15BaSO4:0,04\)
→ 0,11(5-n) = 3.0,07 =0,21 → n = 3,09 thì khí thoát ra có dạng N2On :0,055 mol
Bảo toàn khối lượng có mFe + mDD HNO3 = mX + mkhí → 3,92 + 44,1 = mx + 0,055.(14.2 + 16x)
→ mX = 43,76 gam
→ nồng độ % của Fe(NO3)3 trong X là C%[Fe(NO3)3] = 0,07.242 : 43,76. 100% = 38,7%
Đáp án cần chọn là: C

