Phản ứng oxi hóa - khử
I. KHÁI NIỆM
1. Chất khử
- Chất khử là chất nhường electron
Ví dụ:
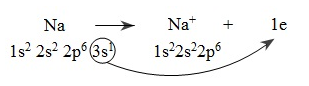
* Quá trình nhường electron gọi là quá trình oxi hóa (hay sự oxi hóa)
2. Chất oxi hóa
- Chất oxi hóa là chất nhận electron
Ví dụ:
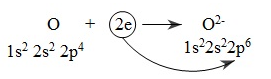
* Quá trình nhận electron gọi là quá trình khử (sự khử)
3. Phản ứng oxi hóa – khử
- Khái niệm: Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển electron giữa các chất phản ứng.
- Dấu hiệu nhận biết: có sự thay đổi số oxi hóa của 1 hay nhiều nguyên tố
Ví dụ 1: $4\overset{0}{\mathop{Na}}\,\,\,\,\,\,\,\,+\,\,\,\,\,\,\,{{\overset{0}{\mathop{O}}\,}_{2}}\,\,\,\,\,\,\to \,\,\,\,\,\,\,2\,{{\overset{+1}{\mathop{Na}}\,}_{2}}\overset{-2}{\mathop{O}}\,$
chất khử chất oxi hóa
Ví dụ 2:
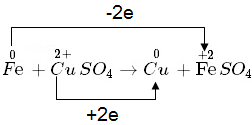
- Nguyên tử Fe nhường electron => là chất khử
- Ion Cu2+ nhận electron => là chất oxi hóa
*Ghi nhớ:
- Khử cho – o nhận (chất khử cho e, chất oxi hóa nhận e)
- Chất tạo môi trường trong phản ứng oxi hóa khử là chất không tham gia cho nhận e. Chất tạo môi trường đôi khi quyết định đến sản phẩm của phản ứng.
Ví dụ: trong phản ứng : 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O có 2 phân tử HNO3 là chất oxi hóa còn 6 phân tử là môi trường
II. LẬP PHƯƠNG TRÌNH HÓA HỌC CỦA PHẢN ỨNG OXI HÓA – KHỬ
Nguyên tắc bảo toàn e: Tổng số electron chất khử cho = tổng số electron chất oxi hóa nhận
Ví dụ: Lập phương trình hóa học của phản ứng sau: Fe2O3 + CO → Fe + CO2
Bước 1: Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi
${{\overset{+3}{\mathop{F\text{e}}}\,}_{2}}{{\overset{{}}{\mathop{O}}\,}_{3}}\,\,+\,\,\,\overset{+2}{\mathop{C}}\,O\,\,\to \,\,\overset{0}{\mathop{F\text{e}}}\,\,\,+\,\,\overset{+4}{\mathop{C}}\,{{O}_{2}}$
Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình
$\overset{+2}{\mathop{C}}\,\,\,\to \,\,\overset{+4}{\mathop{C}}\,\,\,+2\text{e}$ (quá trình oxi hóa)
$\overset{+3}{\mathop{F\text{e}}}\,\,\,+3\text{e}\to \,\,\overset{0}{\mathop{F\text{e}}}\,\,$(quá trình khử)
Bước 3: Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tống số electron mà chất oxi hóa nhận
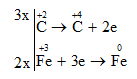
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học
Fe2O3 + 3CO → 2Fe + 3CO2
III. PHÂN LOẠI PHẢN ỨNG OXI HÓA – KHỬ
1. Phản ứng oxi hóa – khử thông thường: chất khử và chất oxi hóa ở 2 phân tử chất khác nhau
Ví dụ: \(\overset{0}{\mathop{Fe}}\,\text{ }+\text{ }\overset{+2}{\mathop{Cu}}\,S{{O}_{4}}\to \overset{+2}{\mathop{Fe}}\,S{{O}_{4}}+\text{ }\overset{0}{\mathop{Cu}}\,\)
2. Phản ứng oxi hóa – khử nội phân tử: chất khử và chất oxi hóa thuộc cùng 1 phân tử nhưng ở 2 nguyên tử khác nhau (thường là phản ứng nhiệt phân)
Ví dụ: 2AgNO3 → 2Ag + 2NO2 + O2
3. Phản ứng tự oxi hóa – khử, chất khử đồng thời cũng là chất oxi hóa (thuộc cùng 1 nguyên tố)
Ví dụ: Cl2 + 2NaOH → NaCl + NaClO + H2O
