Lí thuyết Clo
I. TÍNH CHẤT VẬT LÍ
- Clo là chất khí độc, màu vàng lục, mùi xốc, nặng hơn không khí.
- Khí clo tan vừa phải trong nước tạo thành nước clo có màu vàng nhạt. Clo tan nhiều trong các dung môi hữu cơ.
- Trong tự nhiên clo có 2 đồng vị bền là 35Cl và 37Cl.
II. TÍNH CHẤT HÓA HỌC
- Do lớp e ngoài cùng đã có 7e nên clo là phi kim điển hình, dễ nhận thêm 1e thể hiện tính oxi hóa mạnh.
- Trong các hợp chất, clo thường có mức oxi hóa -1; trong hợp chất với F hoặc O, clo còn có mức oxi hóa +1; +3; +5; +7. Vì vậy trong một số phản ứng, clo còn có tính khử.
1. Tác dụng với kim loại
- Clo phản ứng với hầu hết các kim loại trừ Au và Pt → muối halogenua. Muối thu được thường ứng với mức hóa trị cao của kim loại.
2M + nCl2 → 2MCln
2. Phản ứng với hiđro tạo thành hiđro clorua
H2 + Cl2 $\xrightarrow{as}$ 2HCl
3. Tác dụng với nước
- Cl2 có phản ứng thuận nghịch với nước:
H2O + Cl2 $\overset{{}}{\leftrightarrows}$ HCl + HClO (axit clohiđric và axit hipoclorơ)
Khi để lâu hoặc bị chiếu sáng thì HClO bị phân hủy: HClO → HCl + [O]
[O] sinh ra có tính oxi hóa mạnh nên có thể dùng nước Clo để tẩy màu hoặc sát trùng.
4. Phản ứng với dung dịch kiềm
- Nếu dung dịch kiềm loãng nguội:
Cl2 + 2NaOH → NaCl + NaClO + H2O
(nước Javen)
Cl2 + Ca(OH)2 → CaOCl2 + H2O
(clorua vôi)
- Nếu dung dịch kiềm đặc nóng:
3Cl2 + 6KOH $\xrightarrow{{{100}^{o}}C}$ 5KCl + KClO3 + 3H2O
5. Clo đẩy brom và iot khỏi dung dịch muối bromua và iotua (không đẩy được muối florua)
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2KI → 2KCl + I2
6. Tác dụng với các hợp chất có tính khử
3Cl2 + 2NH3 → N2 + 6HCl (phản ứng dùng để khử độc khí clo trong phòng thí nghiệm)
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
III. ĐIỀU CHẾ
1. Trong công nghiệp
- Điện phân dung dịch muối halogenua của kim loại kiềm có màng ngăn: 2NaCl + 2H2O → H2 + 2NaOH + Cl2
2. Trong phòng thí nghiệm
Cho HX tác dụng với các chất oxi hóa mạnh (thường gặp: MnO2, KMnO4, K2Cr2O7, KClO3)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
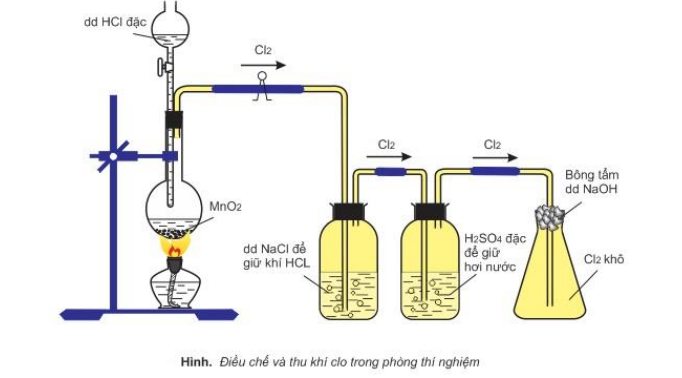
Nhận xét:
- Khí HCl và H2O lẫn trong quá trình điều chế vì dd HCl dùng là dd đậm đặc, dễ bay hơi nên tách ra khỏi dd tạo khí HCl lẫn vào sản phẩm. Khi đun nóng, H2O bay hơi một phần tạo hơi H2O, nên sản phẩm ngoài Cl2 còn có HCl và H2O.
- Tại sao bình 1 lại dùng dd NaCl bão hòa mà không dùng dd khác: vì độ háo nước của HCl > NaCl > Cl2. Khi dẫn hỗn hợp sản phẩm vào dd NaCl bão hòa thì HCl hòa tan làm tăng nồng độ Cl- tạo kết tinh NaCl.xH2O, làm giảm khả năng hòa tan của Cl2.
- Vai trò của bông tẩm NaOH: ngăn Cl2 thoát ra ngoài (có thể thay bằng nước vôi trong)
IV. ỨNG DỤNG
- Dùng làm chất sát trùng trong hệ thống cung cấp nước sạch.
- Tẩy trắng vải, sợi, giấy...
- Là nguyên liệu để sản xuất nhiều hợp chất hữu cơ và vô cơ.
V. TRẠNG THÁI TỰ NHIÊN
- Clo chủ yếu tồn tại ở dạng muối clorua, quan trọng nhất là NaCl có trong nước biển và đại dương. KCl cũng khá phổ biến, nó có trong khoáng vật cacnalit KCl.MgCl2.6H2O và xinvinit NaCl.KCl.
