Axit sunfuric loãng và muối sunfat
I. AXIT SUNFURIC
1. Tính chất vật lí
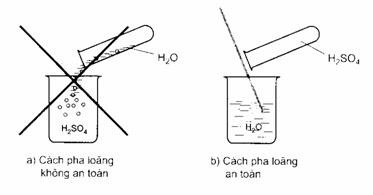
Cách pha loãng axít H2SO4 đặc
- Axit sunfuric (H2SO4) là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84 g/cm3).
- H2SO4 tan vô hạn trong nước và toả nhiệt rất nhiều nhiệt. Nếu ta rót nước vào H2SO4, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Vì vậy, muốn pha loãng axit H2SO4 đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thuỷ tinh mà không được làm ngược lại.
2. Tính chất hóa học
* Tính chất của dung dịch axit sunfuric loãng
Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học (trừ Pb), giải phóng khí hiđro:
Fe + H2SO4 → FeSO4 + H2
Phương pháp giải:
+ Bảo toàn nguyên tố : ngốc SO4 = ${{n}_{{{H}_{2}}}}={{n}_{{{H}_{2}}S{{O}_{4}}}}$
+ Bảo toàn khối lượng: mmuối = mkim loại + ${{m}_{{{H}_{2}}S{{O}_{4}}}}$ - ${{m}_{{{H}_{2}}}}$= mkim loại + $96.{{n}_{{{H}_{2}}}}$
- Tác dụng với oxit bazơ và với bazơ:
CuO + H2SO4 → CuSO4 + H2O
Phương pháp giải:
+ Bảo toàn nguyên tố H: ${{n}_{{{H}_{2}}S{{O}_{4}}}}={{n}_{{{H}_{2}}O}}={{n}_{O\,\,(trong\,\,oxit)}}$
+ Bảo toàn khối lượng: mmuối = moxit + ${{m}_{{{H}_{2}}S{{O}_{4}}}}$- ${{m}_{{{H}_{2}}O}}$ = moxit + 80.${{n}_{{{H}_{2}}S{{O}_{4}}}}$ = moxit + 80.nO (trong oxit)
- Tác dụng với bazơ:
2NaOH + H2SO4 → Na2SO4 + 2H2O
- Tác dụng được với nhiều muối (điều kiện: sau phản ứng sinh ra kết tủa, chất khí hoặc H2O)
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
II. MUỐI SUNFAT
Muối sunfat là muối của axit sunfuric. Có 2 loại muối sunfat:
- Muối trung hoà (muối sunfat) chứa ion sunfat SO42-. Phần lớn muối sunfat đều tan trừ BaSO4, SrSO4, PbSO4 không tan; CaSO4 và Ag2SO4 ít tan.
- Muối axit (muối hiđrosunfat) chứa ion hiđrosunfat HSO4-
III. NHẬN BIẾT ION SUNFAT
Thuốc thử nhận biết muối sunfat là dung dịch muối bari. Sản phẩm phản ứng là BaSO4 kết tủa trắng, không tan trong axit.
H2SO4 + BaCl2 → BaSO4 ↓ + 2HCl
Na2SO4 + Ba(OH)2 → BaSO4 ↓ + 2NaOH
