Bài tập lưu huỳnh
I. VỊ TRÍ, CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ
- Cấu hình electron: 1s22s22p63s23p4
- Vị trí: Z = 16, chu kì 3, nhóm VIA
=> Lớp ngoài cùng có 6 electron trong đó có 2 electron độc thân
II. TÍNH CHẤT VẬT LÍ

- Là chất bột màu vàng, không tan trong nước nhưng tan trong các dung môi hữu cơ.
- Lưu huỳnh có 2 dạng thù hình: lưu huỳnh tà phương (Sa) và lưu huỳnh đơn tà (Sb).
III. TÍNH CHẤT HÓA HỌC
- S có 6e ở lớp ngoài cùng → dễ nhận 2e thể hiện tính oxi hóa mạnh. Tính oxi hóa của S yếu hơn so với O.
Các mức oxi hóa có thể có của S: -2, 0, +4, +6. Ngoài tính oxi hóa, S còn có tính khử.
1. Tính oxi hóa
- Tác dụng với hiđro: H2 + S $\xrightarrow{{{350}^{o}}C}$ H2S
- Tác dụng với kim loại
+ S tác dụng với nhiều kim loại → muối sunfua (trong đó kim loại thường chỉ đạt đến hóa trị thấp, hầu hết xảy ra ở nhiệt độ cao).
Fe + S $\xrightarrow{{{t}^{o}}}$ FeS
Hg + S → HgS (phản ứng xảy ra ở ngay nhiệt độ thường nên thường dùng S khử độc Hg)
Chú ý: Một số muối sunfua có màu đặc trưng: CuS, PbS, Ag2S (màu đen); MnS (màu hồng); CdS (màu vàng)
→ thường được dùng để nhận biết gốc sunfua.
2. Tính khử
- Tác dụng với oxi: S + O2 $\xrightarrow{{{t}^{o}}}$ SO2
- Tác dụng với các chất có tính oxi hóa mạnh: S + 2H2SO4 đặc $\xrightarrow{{{t}^{o}}}$ 3SO2 + 2H2O
IV. ỨNG DỤNG
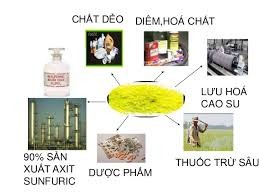
+ Là nguyên liệu cho nhiều ngành công nghiệp:
+ 90% dùng để sản xuất H2SO4.
+ 10% để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm nông nghiệp...
