Ôn tập chương nguyên tử
I. Nguyên tử
|
|
Hạt nhân |
Vỏ nguyên tử |
|
|
Proton (p) |
Nơtron (n) |
Electron (e) |
|
|
Khối lượng (m) |
1,6726.10-27 kg = 1u |
1,6748.10-27 kg = 1u |
9,1094.10-31 kg = 0,00055u |
|
Điện tích (q) |
+ 1,602.10-19 C = 1+ |
0 |
– 1,602.10-19 C = 1– |
- Điều kiện bền của nguyên tử: p ≤ n ≤ 1,5.p
- Vì nguyên tử trung hòa về điện: số p = số e
- Khối lượng nguyên tử: mnguyên tử \( \approx \) hạt nhân \( \approx \) mp + mn
- Nếu hạt nhân có Z proton thì điện tích hạt nhân bằng Z+
- Số đơn vị điện tích hạt nhân (Z) = số hiệu nguyên tử = số electron (e) = số proton (p)
Lưu ý: phân biệt số đơn vị điện tích hạt nhân (Z) và điện tích hạt nhân (Z+)
- Số khối: A = Z + N
II. NGUYÊN TỐ HÓA HỌC VÀ ĐỒNG VỊ
- Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân.
- Kí hiệu nguyên tử : \({}_Z^AX\)
X : kí hiệu của nguyên tố
Z: số hiệu nguyên tử
A: số khối (A = Z + N)
- Đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số hạt proton, electron (cùng Z) nhưng khác nhau về số khối (khác A hoặc khác số nơtron)
III. NGUYÊN TỬ KHỐI TRUNG BÌNH
\(\bar M = \dfrac{{{x_1}.{A_1} + {x_2}.{A_2} + ... + {x_n}.{A_n}}}{{100}}\)
Trong đó A1, A2,…, An là số khối của các đồng vị tương ứng
x1, x2,…, xn là phần trăm số nguyên tử của đồng vị A1, A2,…, An
IV. LỚP ELECTRON VÀ PHÂN LỚP ELECTRON
Lớp electron:
Thứ tự lớp: 1 2 3 4 5 6 7
Tên lớp: K L M N O P Q
Phân lớp electron
* Số electron tối đa trong một phân lớp
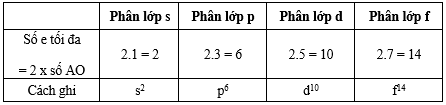
- Phân lớp đã đủ số electron tối đa gọi là phân lớp electron bão hòa.
* Số electron tối đa trong một lớp
| Lớp K | Lớp L | Lớp M | Lớp N | |
| Thứ tự | n=1 | n=2 | n=3 | n=4 |
| Số phân lớp | 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
| Số e tối đa (2.n2) | 2e | 8e | 18e | 32e |
- Lớp electron đã đủ số e tối đa gọi là lớp electron bão hòa.
- Lớp electron bão hòa khi các phân lớp trong lớp đó bão hòa.
V. CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ
1. Các bước viết cấu hình e nguyên tử
B1: Điền lần lượt các e vào các phân lớp theo thứ tự tăng dần mức năng lượng:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
B2: Sắp xếp lại theo thứ tự các lớp và phân lớp theo nguyên tắc từ trong ra ngoài:
1s 2s 2p 3s 3p 3d 3f 4s 4p 4d 4f …
B3: Xem xét phân lớp nào có khả năng đạt đến bão hòa hoặc bán bão hòa thì có sự sắp xếp lại các electron ở các phân lớp (chủ yếu là d và f)
Chú ý: trường hợp đặc biệt: Các nguyên tố có cấu hình nguyên tử bán bão hòa:
Cr (Z = 24) 1s22s22p63s23p63d44s2 chuyển thành 1s22s22p63s23p63d54s1
Cu (Z = 29) 1s22s22p63s23p63d94s2 chuyển thành 1s22s22p63s23p63d104s1
2. Đặc điểm của lớp e ngoài cùng dẫn đến tính chất
Các nguyên tố luôn có xu hướng nhường nhận electron để đạt cấu hình bát tử của khí hiếm (8e lớp ngoài cùng trừ He)
- Kim loại là những chất có khả năng nhường electron
=> Kim loại có: 1, 2, 3 e lớp ngoài cùng => xu hướng nhường 1, 2, 3 e
Ví dụ Na (Z = 11): 1s22s22p63s1 => xu hướng nhường 1 e để đạt cấu hình Na+:1s22s22p6 => Na là kim loại.
- Phi kim là những chất có khả năng nhận electron
=> Phi kim : 5, 6, 7 e lớp ngoài cùng => Xu hướng nhận 3, 2, 1 e
Ví dụ Cl (Z=17): 1s22s22p63s23p5 => xu hướng nhận 1e để đạt cấu hình Cl-:1s22s22p63s23p6 => Clo là phi kim.
Chú ý: Nguyên tử có 4 electron ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim.
